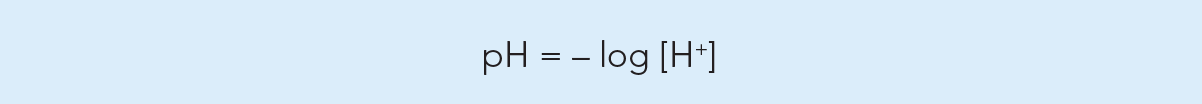CHEMIE DER MILCH

Die Hauptinhaltsstoffe der Milch sind Wasser; Fett, Proteine, Laktose (Milchzucker) und Mineralstoffe (Salze). Milch enthält daneben Spuren anderer Stoffe wie Pigmente, Enzyme, Vitamine, Phospholipide (Stoffe mit fettähnlichen Eigenschaften) und Gase.
Der nach Entfernen von Wasser und Gasen verbleibende Rückstand wird als Trockenmasse (TM) oder Trockensubstanz (TS) bzw. Gesamtinhaltstoffe der Milch bezeichnet.
Milch ist ein sehr komplexes Produkt. Um die verschiedenen Milchbestandteile und deren Beeinflussung durch die verschiedenen Behandlungsstufen in einer Molkerei zu beschreiben, muss man sich der chemischen Terminologie bedienen. Dieses Kapitel über die Milchchemie beginnt daher mit einem kurzen Überblick über einige grundlegende chemische Zusammenhänge.
C Kohlenstoff
Cl Chlor
H Wasserstoff
I Jod
K Kalium
N Stickstoff
Na Natrium
O Sauerstoff
P Phosphor
S Schwefel
Chemische grundlagen
ATOME
In der Natur ist ein Atom der kleinste Materiebaustein. Er kann chemisch nicht weiter zerlegt werden. Eine Substanz, in der alle Atome von gleicher Art sind, wird als Element bezeichnet. Bis heute sind über 100 Elemente bekannt. Beispiele sind Sauerstoff, Kohlenstoff, Kupfer, Wasserstoff und Eisen. Die meisten natürlich vorkommenden Stoffe bestehen jedoch aus verschiedenen Elementen. Luft ist z. B. eine Mischung aus Sauerstoff, Stickstoff, Kohlendioxid und seltenen Gasen, während Wasser eine chemische Verbindung von Sauerstoff und Wasserstoff ist.
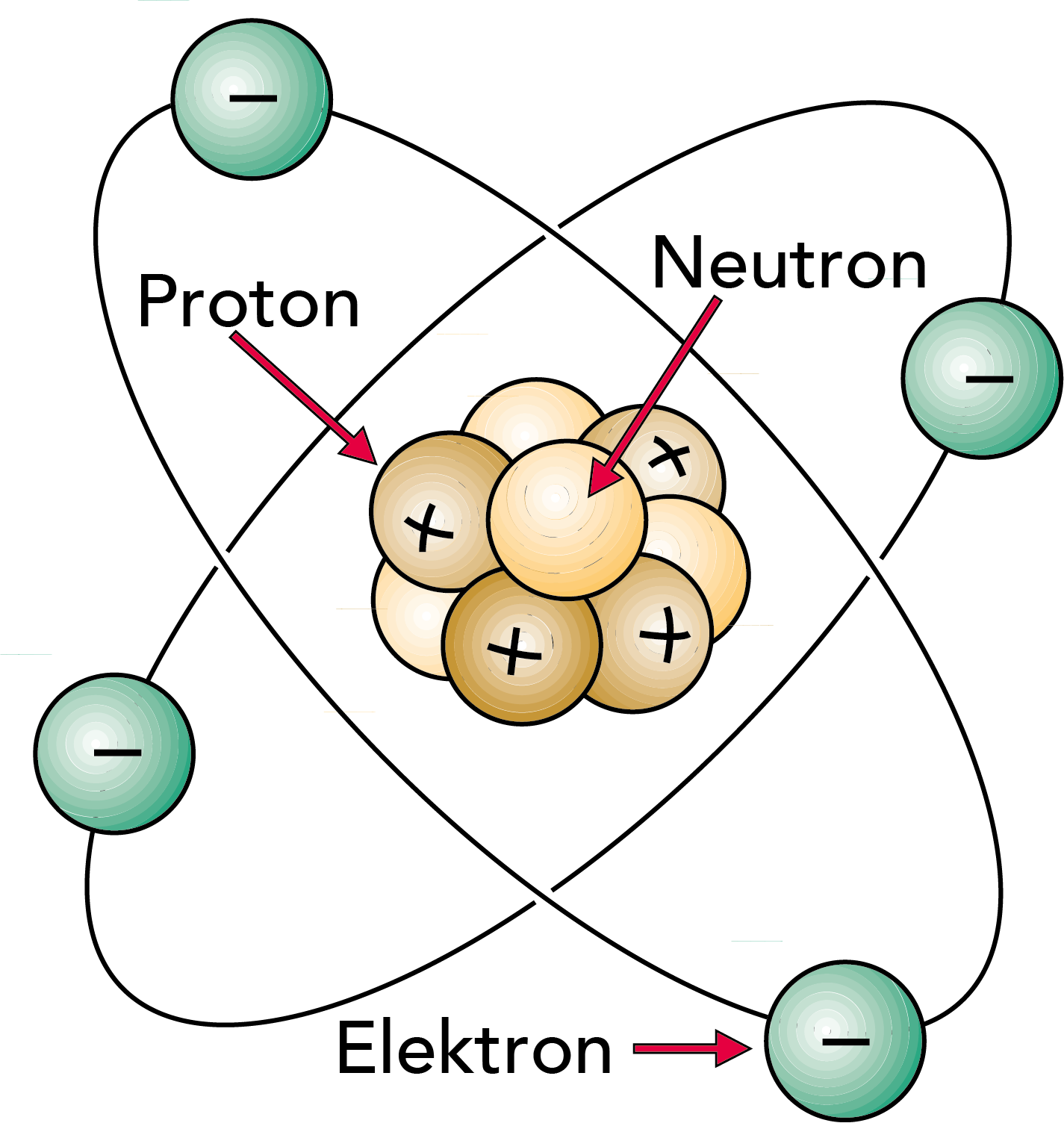
Der Atomkern besteht aus Protonen und Neutronen (vgl. Abb. 2.1). Die Protonen tragen eine positive Ladungseinheit, die Neutronen sind elektrisch neutral. Die Elektronen, die den Kern umkreisen, tragen eine negative Ladung, die gleich hoch, aber der des Protons entgegengesetzt ist.
Ein Atom enthält die gleiche Zahl an Protonen und Elektronen mit einer gleichen Zahl positiver und negativer Ladungen. Das Atom verhält sich daher elektrisch neutral.
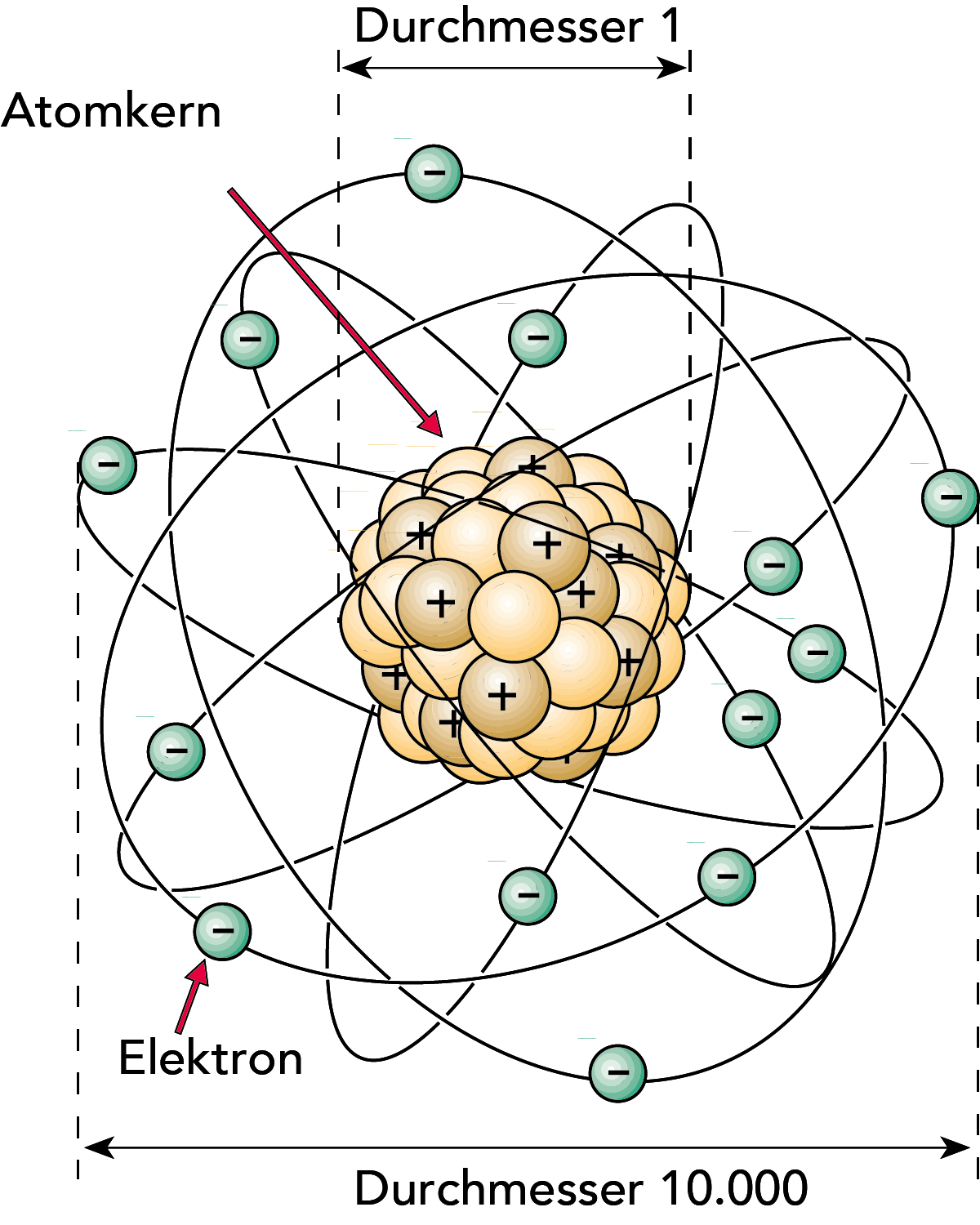
Ein Atom ist sehr klein (vgl. Abb. 2.2). ln einer kleinen Kupfermünze befinden sich z. B. etwa so viele Atome wie ein Tausend Millionen Jahre umfassender Zeitraum Sekunden zählt! Dennoch besteht das Atom in der Hauptsache aus leerem Raum. Definieren wir z. B. den Durchmesser des Kerns als 1, dann würde das gesamte Atom einen Durchmesser von ca. 10.000 haben.
IONEN
Ein Atom kann Elektronen verlieren oder hinzugewinnen. Ein solches Atom ist dann nicht mehr elektrisch neutral. Es wird als Ion bezeichnet. Enthält das Ion mehr Elektronen als Protonen, dann ist es negativ geladen, hat es ein oder mehrere Elektronen abgegeben, ist es positiv geladen.
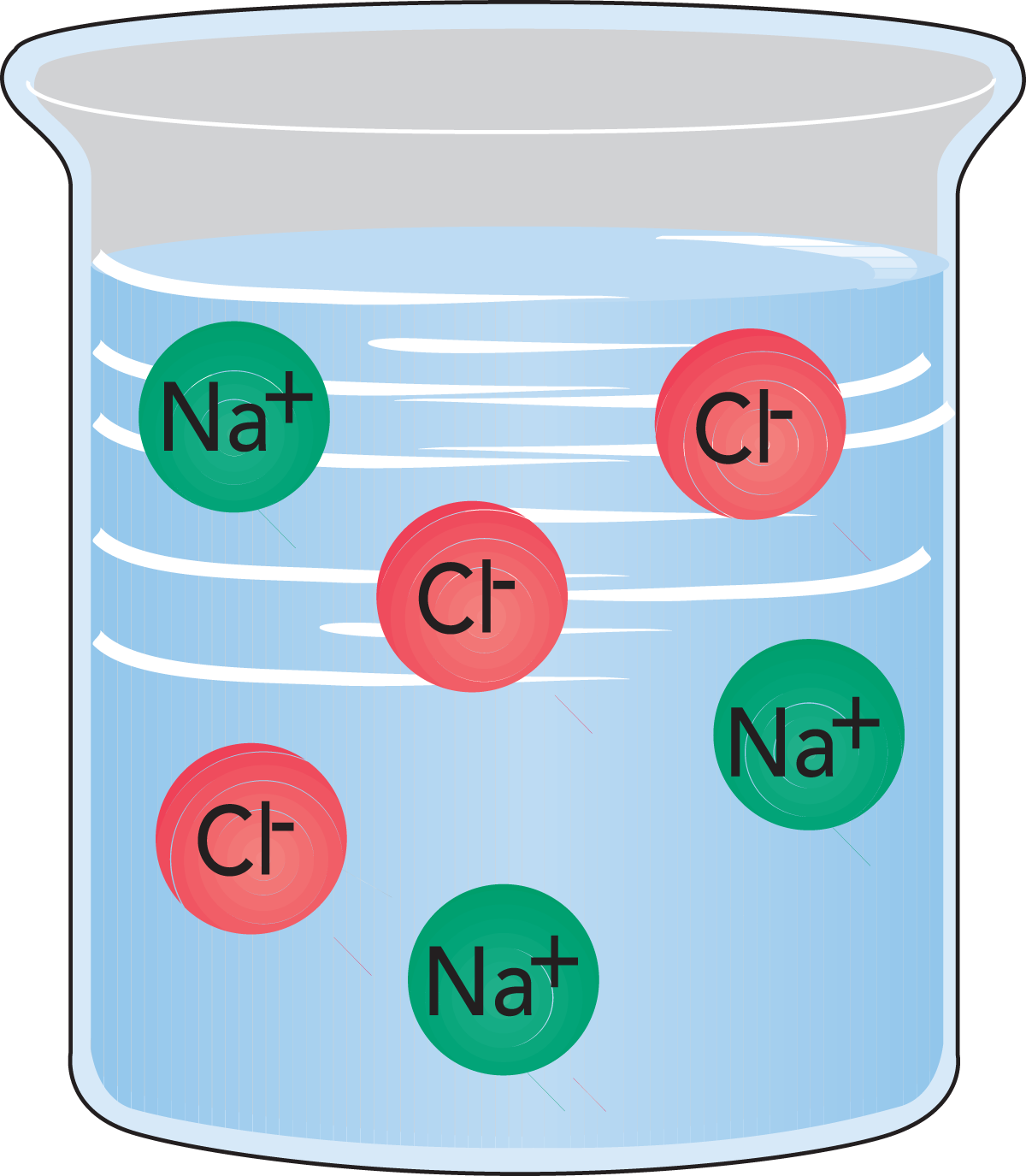
Positive und negative Ionen sind stets gleichzeitig anwesend, d. h. in Lösungen als Kationen (positive Ladung) und Anionen (negative Ladung) oder in fester Form als Salze. Herkömmliches Salz besteht aus Natrium-(Na)- und Chlor-(Cl)-Ionen und besitzt die Formel NaCI (Natriumchlorid).
MOLEKÜLE
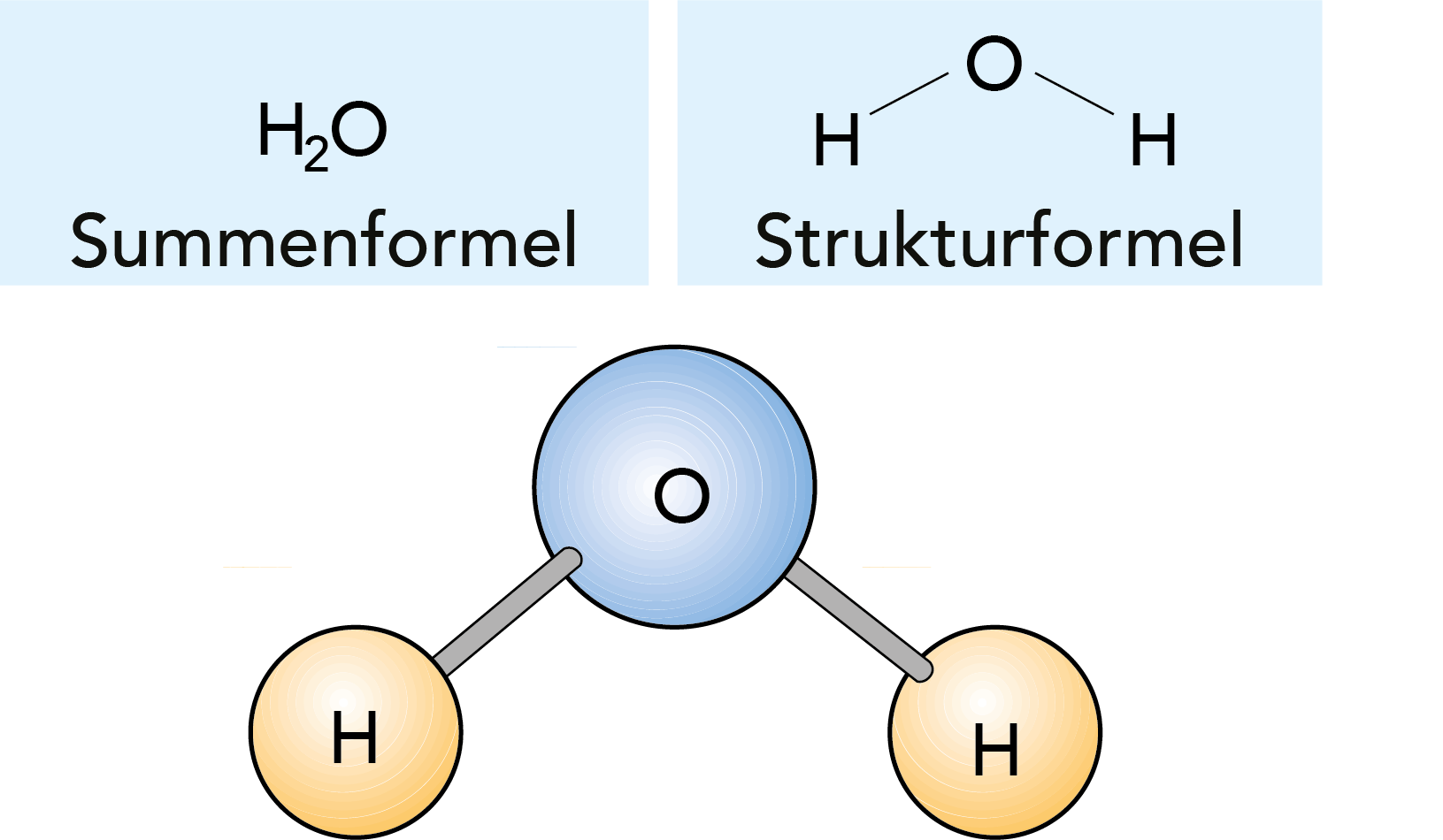
Atome eines oder verschiedener Elemente können sich zu größeren Einheiten verbinden, die als Moleküle bezeichnet werden. Moleküle können Feststoffe, wie z. B. Eisen (Fe) oder Silikatsand (SiO2), Flüssigkeiten wie z. B. Wasser (H2O) oder Gase wie beispielsweise Wasserstoff (H2) ausbilden. Besteht das Molekül vor allem aus Kohlenstoff-(C)-, Wasserstoff (H2)- und Sauerstoff-(O2)-Atomen, wird die daraus gebildete Verbindung als organisch bezeichnet, d. h. von organischen Elementen gebildet. Ein Beispiel ist Milchsäure (C3H603). Die Formel deutet an, dass das Molekül aus drei Kohlenstoff-, sechs Wasserstoff- und drei Sauerstoffatomen gebildet wird.
Die Zahl an Atomen in einem Molekül kann beträchtlich schwanken. Es gibt Moleküle, die aus zwei gebundenen Atomen bestehen, andere wiederum setzen sich aus Hunderten von Atomen zusammen.
Grundlegende physikalisch-chemische eigenschaften von kuhmilch
Kuhmilch besteht aus rund 87 % Wasser und 13 % Trockenmasse, Tabelle 2.1. Die Trockenmasse wird in Wasser suspendiert oder aufgelöst. Die Feststoffe in der Wasserphase sind abhängig von der Lösungsart und Größe der Partikel (Tabelle 2.2) unterschiedlich verteilt.
DEFINITIONEN
Emulsion: eine Verteilung von Tropfen einer Flüssigkeit in einer anderen. Milch ist eine Emulsion von Öl in Wasser, Butter eine von Wasser in Öl, Abb. 2.5. Die fein verteilte Flüssigkeit wird als disperse Phase, die andere als kontinuierliche Phase bezeichnet. Kolloidale Lösung: Befindet sich ein Stoff in einem Stadium zwischen einer echten Lösung (z. B. Zucker in Wasser) und einer Suspension (z. B. Kalk in Wasser), bezeichnet man ihn als kolloidal gelöst oder suspendiert.
Typische Eigenschaften eines Kolloids sind:
- geringe Teilchengröße
- elektrische Ladung und
- Affinität der Teilchen zu Wassermolekülen.
Substanzen wie Salze destabilisieren kolloidale Systeme durch Veränderung der Wasserbindung, wodurch z. B. die Löslichkeit von Proteinen zurückgeht. Faktoren wie Hitze verursachen das Auffalten der Molkenproteine und eine verstärkte Wechselwirkung zwischen den Eiweißen. Alkohol kann auf Teilchen entwässernd wirken.
Reine Lösungen: Stoffe, die mit Wasser oder anderen Flüssigkeiten vermengt reine Lösungen bilden, werden unterteilt in:
- Nicht-ionische Lösungen. Wird Laktose in Wasser gelöst, kommt es zu keinen größeren Veränderungen der molekularen Struktur der Laktose.
- Ionische Lösungen. Wird gewöhnliches Salz in Wasser gelöst, verteilen sich Kationen (Na+) und Anionen (Cl–) im Wasser, wodurch sich ein Elektrolyt bildet, Abb. 2.7.
SÄUREGRAD VON LÖSUNGEN
Wird eine Säure (z. B. Salzsäure HCI) mit Wasser gemischt, werden Wasserstoffionen (Protonen) mit einer positiven Ladung (H+) freigesetzt. Diese lagern sich schnell an Wassermoleküle an und bilden so Hydroniumionen (H30+).
Wird eine Base (Metalloxid oder -hydroxid) in Wasser gegeben, bildet sich eine basische oder alkalische Lösung. Bei der Lösung der Base werden Hydroxidionen (OH–) frei.
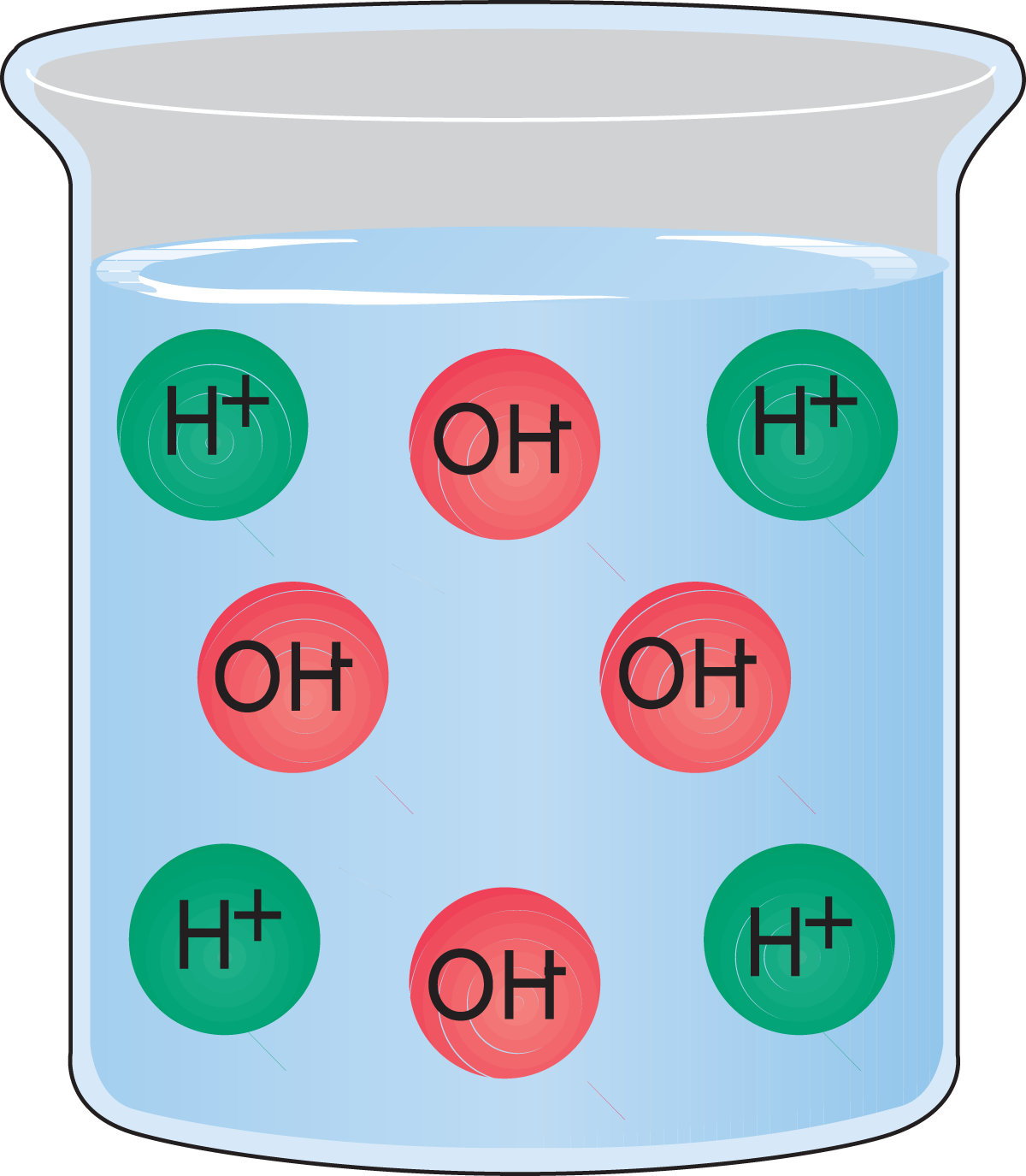
- Eine Lösung, die gleiche Anteile an Hydroxid- und Hydroniumionen aufweist, ist neutral. Abb. 2.8.
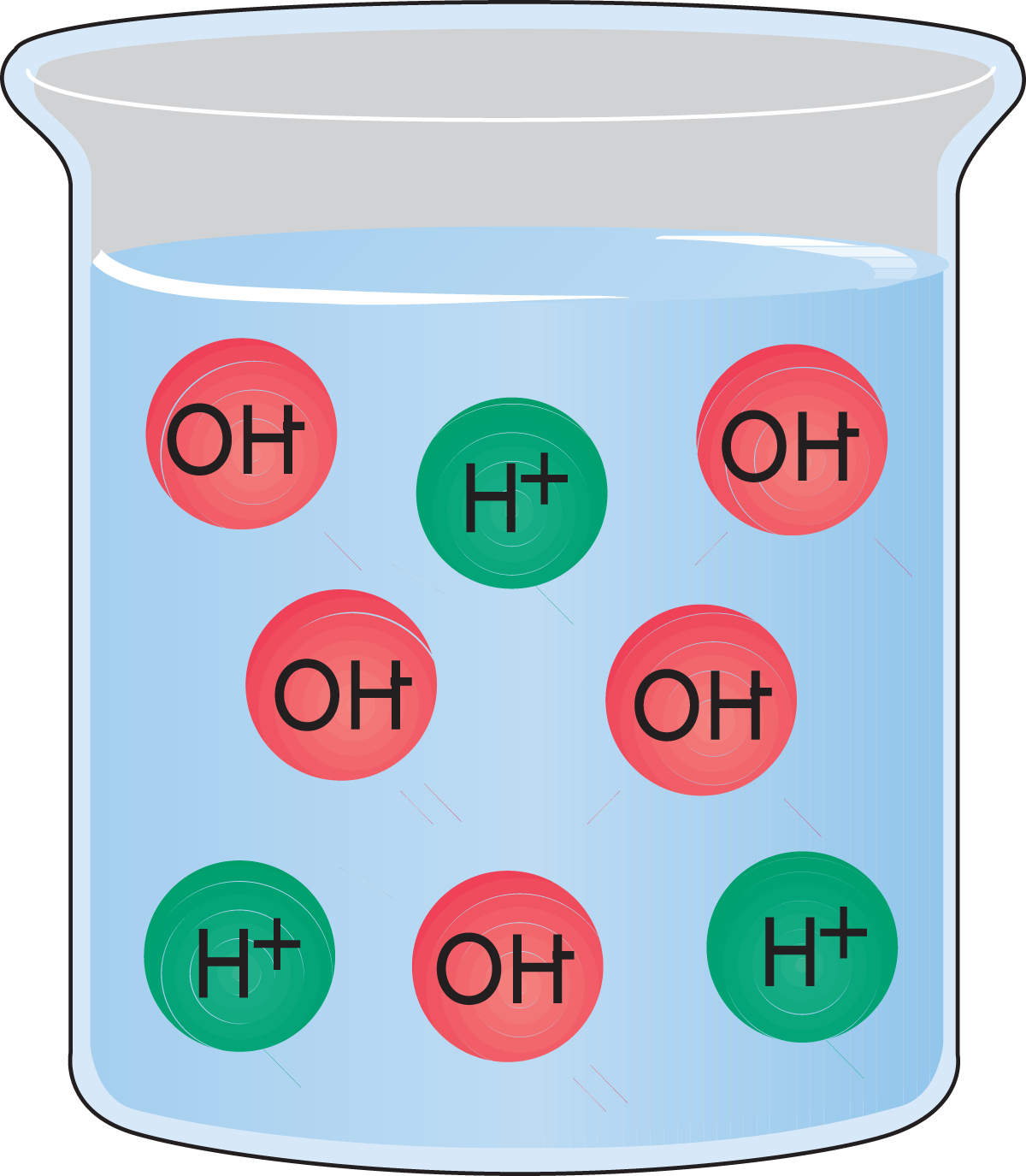
- Eine Lösung, die mehr Hydroxidionen als Hydroniumionen enthält, ist alkalisch. Abb. 2.9.
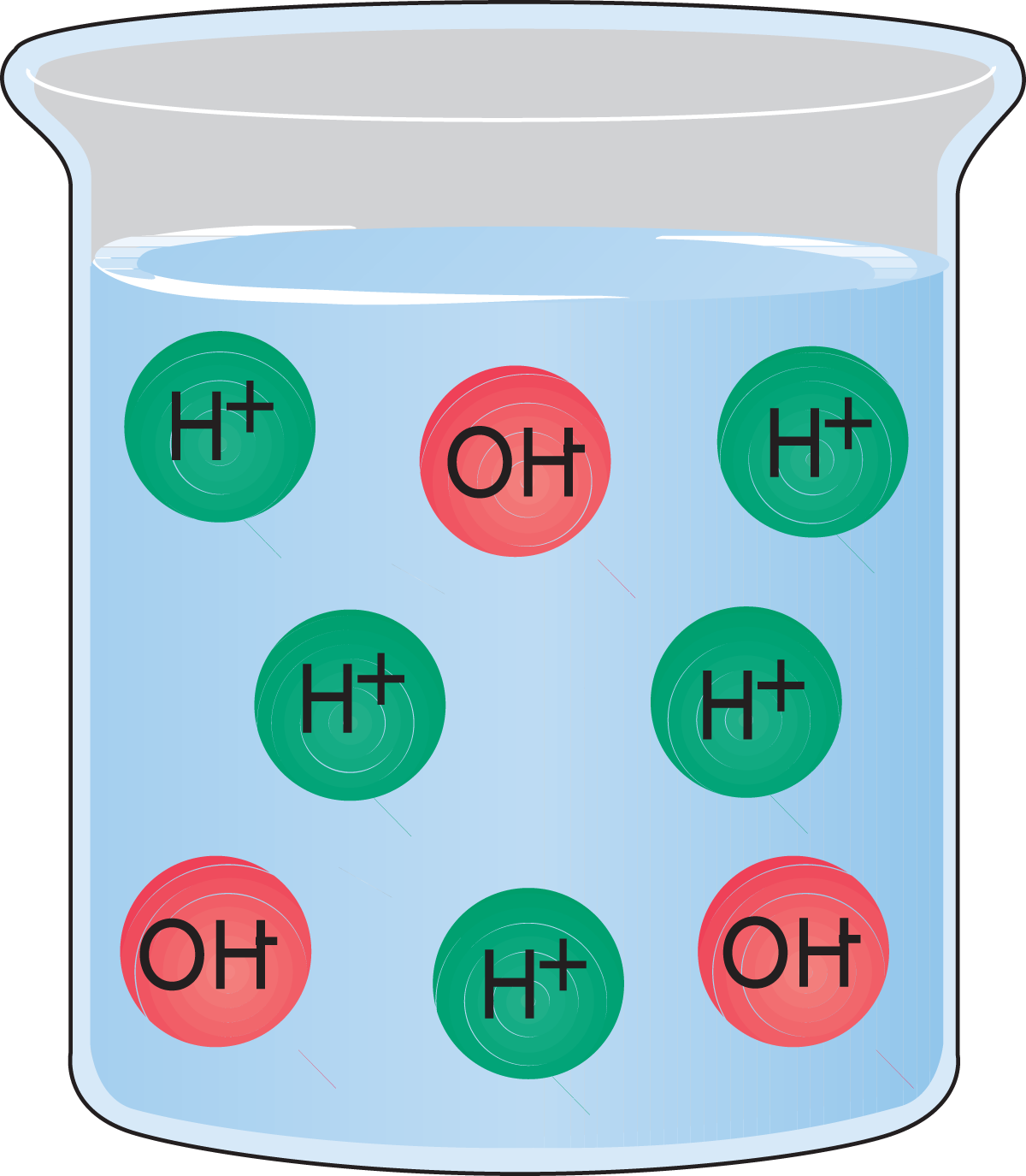
- Eine Lösung, die mehr Hydroniumionen als Hydroxidionen enthält, ist sauer. Abb. 2.10.
pH-WERT
Der Säuregrad einer Lösung wird durch die Konzentration der Hydroniumionen bestimmt. Dies variiert jedoch in hohem Maße von einer Lösung zur anderen. Das Symbol pH wird benutzt, um die Hydroniumionenkonzentration anzugeben.
Mathematisch wird der pH-Wert als negativer dekadischer Logarithmus der Hydroniumionenkonzentration in Molarität (Grammol je Liter Lösung) ausgedrückt, d. h. pH = – log [H+].
Dies führt zu folgender Einteilung bei 25 °C:
pH = 7 – neutrale Lösung
pH < 7 – saure Lösung
NEUTRALISATION
Wird Säure mit einer Lauge gemischt, reagieren die Hydronium- und Hydroxidionen miteinander, indem sie Wasser bilden. Werden Säure und Lauge in bestimmten Anteilen gemischt, ist die entstehende Lösung neutral, ohne Überschuss an Hydronium- oder Hydroxidionen, bei einem pH-Wert von 7. Dieser Prozess wird als Neutralisation bezeichnet und folgt der chemischen Gleichung:
Neutralisation führt zur Bildung eines Salzes. Wird Salzsäure (HCI) mit Natriumhydroxid (NaOH) gemischt, reagieren beide Stoffe mit der Bildung von Natriumchlorid (NaCI) und Wasser (H20). Die Salze der Salzsäure werden als Chloride bezeichnet, andere Salze werden in ähnlicher Weise nach den Säuren bezeichnet, von denen sie gebildet werden: Zitronensäure bildet Zitrate, Stickstoffsäuren bilden Nitrate usw.
DIFFUSION
Die in einer Lösung vorliegenden Teilchen – Ionen, Moleküle oder Kolloide – unterliegen Kräften, die sie zum Wandern (Diffundieren) aus Zonen hoher Konzentration in Zonen geringer Konzentration zwingen. Der Diffusionsprozess hält so lange an, bis die ganze Lösung homogen ist, sodass die Konzentration überall gleiche Werte annimmt.
Ein Beispiel ist das Lösen von Zucker in einer Tasse Kaffee. Der Zucker löst sich im heißen Getränk schnell auf, die Zuckermoleküle diffundieren, bis sie gleichmäßig im Getränk verteilt sind.
Die Diffusionsrate hängt von der Teilchengeschwindigkeit ab, die ihrerseits von der Temperatur, der Größe der Teilchen und dem Konzentrationsunterschied in verschiedenen Teilen der Lösung abhängig ist.
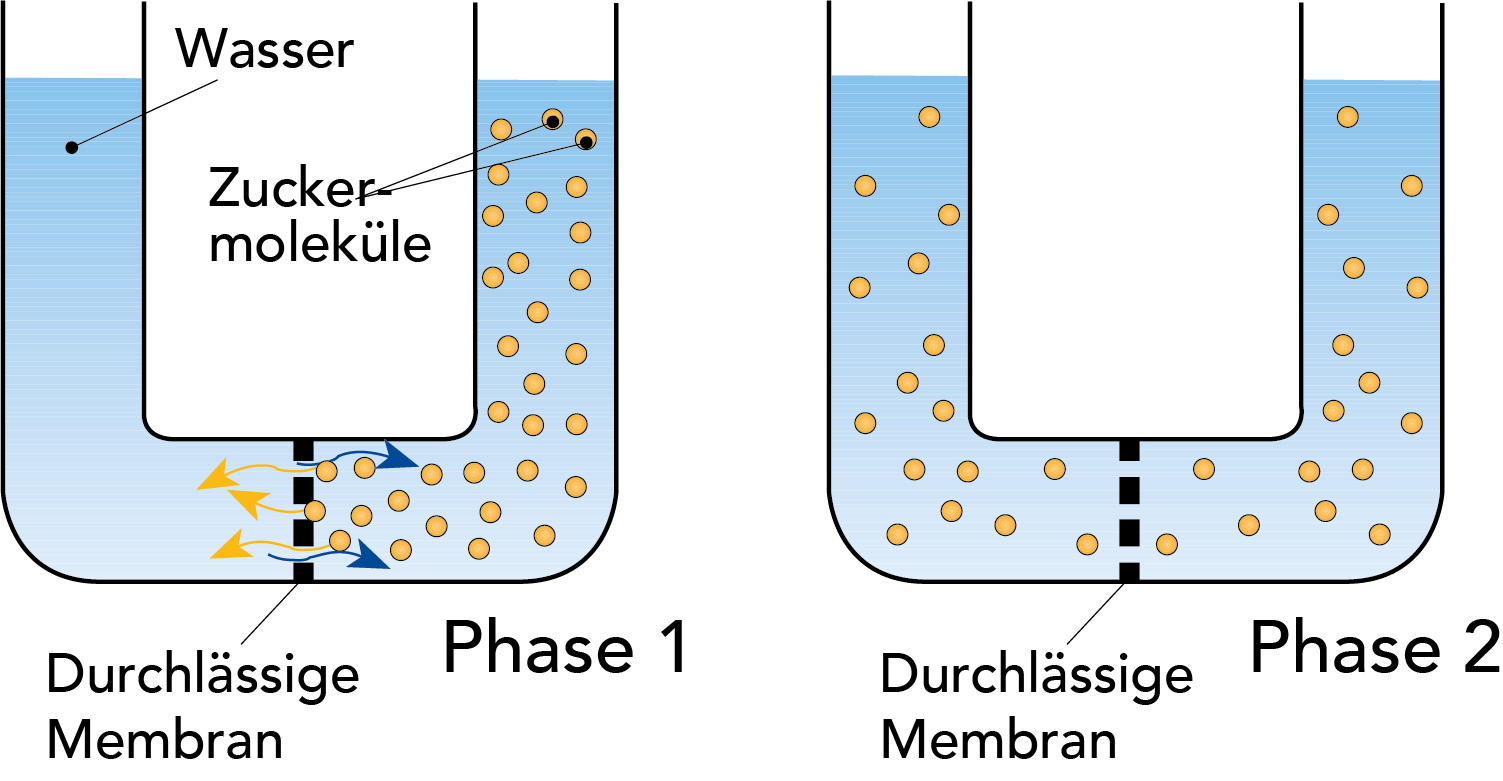
Abb. 2.11 zeigt das Prinzip des Diffusionsprozesses. Das U-Rohr wird durch eine permeable Membran in zwei Abteilungen getrennt. Der linke Teil wird mit Wasser, der rechte mit einer Zuckerlösung befüllt, wobei die Zuckermoleküle durch die Membran passieren können. Nach einer Weile hat sich die Konzentration des Zuckers durch Diffusion auf beiden Seiten der Membran egalisiert.
OSMOSE
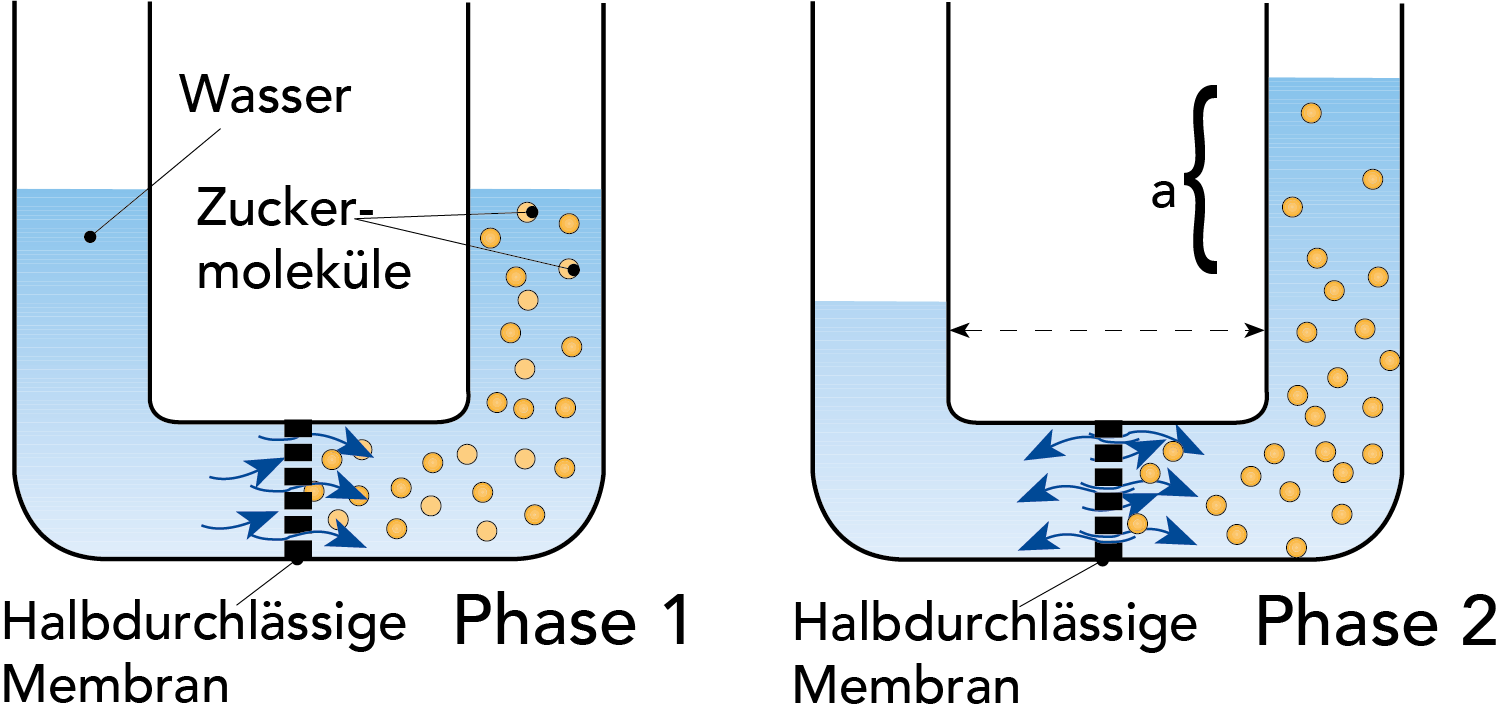
Osmose bezeichnet den spontanen Zustrom reinen Wassers in eine wässrige Lösung, oder aus einer geringer in eine höher konzentrierte Lösung durch eine geeignete Membran hindurch. Das Phänomen der Osmose lässt sich durch das in Abb. 2.12 gezeigte Beispiel veranschaulichen. Die U-Rohre sind durch eine semipermeable Membran in zwei Abteilungen getrennt. Der linke Teil wird mit Wasser, der rechte mit einer Zuckerlösung befüllt, wobei die Zuckermoleküle nicht durch die Membran passieren können. Die Wassermoleküle diffundieren nun durch die Membran in die Zuckerlösung und verdünnen sie auf eine niedrigere Konzentration. Dieser Prozess wird als Osmose bezeichnet.
Das Volumen der Zuckerlösung vergrößert sich mit dem Verdünnen. Die Oberfläche der Lösung steigt an, wie in Abb. 2.12 gezeigt, und der hydrostatische Druck, „a", der Lösung auf die Membran steigt über den Wasserdruck auf der anderen Seite. In diesem Ungleichgewichtszustand beginnen Wassermoleküle unter dem Einfluss des höheren hydrostatischen Drucks in der Lösung zurück auf die andere Seite zu diffundieren.
Gleicht sich die Diffusion von Wasser in beide Richtungen aus, so befindet sich das System im Gleichgewicht. Wirkt auf die Zuckerlösung von Anfang an hydrostatischer Druck, kann die Aufnahme von Wasser durch die Membran hindurch reduziert werden. Der hydrostatische Druck, der nötig ist, um einen Ausgleich der Konzentration durch Wasserdiffusion in die Zuckerlösung zu verhindern, wird als osmotischer Druck der Lösung bezeichnet.
UMKEHROSMOSE
Wird die Zuckerlösung mit einem über dem osmotischen Druck liegenden Druck beaufschlagt, können Wassermoleküle aus der Lösung zum Diffundieren auf die Wasserseite gezwungen werden, sodass die Konzentration der Lösung ansteigt. Dieses Prinzip (vgl. Abb. 2.13) wird kommerziell zur Konzentration von Lösungen angewendet und als Umkehrosmose (RO) bezeichnet.
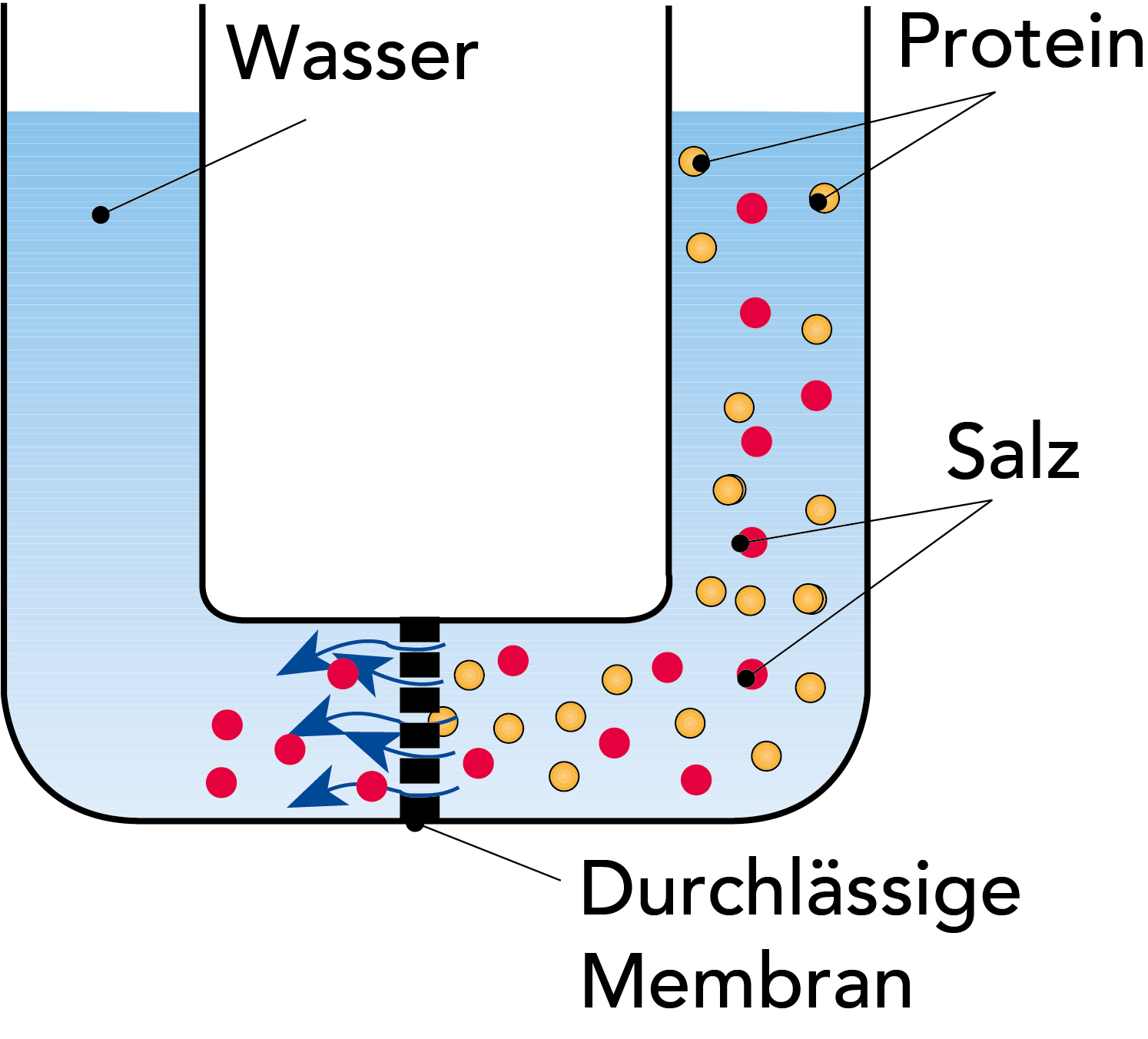
DIALYSE
Dialyse ist eine Technologie, die Konzentrationsunterschiede als Antriebskraft zum Abtrennen von großen Teilchen von kleineren aus einer Lösung nutzt, z. B. die Abtrennung von Proteinen aus Salzen. Die zu behandelnde Lösung wird auf einer Seite einer Membran platziert, das Lösungsmittel (Wasser) auf der anderen Seite. Die Membran hat Poren mit einem Durchmesser, der Salzmolekülen den Durchtritt erlaubt, Proteinmoleküle aufgrund ihrer Größe jedoch zurückhält, vgl. Abb. 2.14.
Die Diffusionsrate hängt vom Konzentrationsunterschied ab, sodass sich die Dialyse durch oftmaliges Auswechseln des Lösungsmittels auf der anderen Seite der Membran beschleunigen lässt.
Zusammensetzung von kuhmilch
Die Hauptinhaltsstoffe der Milch können mengenmäßig beträchtlich zwischen Kühen verschiedener Rassen und individuellen Tieren derselben Rasse schwanken. Daher können für die Bandbreite nur Grenzwerte aufgestellt werden. Die Zahlen in Tabelle 2.3 dienen lediglich als Beispiele.
Neben der Gesamttrockenmasse wird der Ausdruck fettfreie Trockenmasse (ffTr) bei der Beschreibung der Milchzusammensetzung benutzt. Der Begriff ffTr entspricht der Gesamttrockenmasse abzüglich des Fettgehaltes. Die durchschnittliche ffTr beträgt lt. Tabelle 2.3 13,0 - 3,9 = 9,1 %. Der pH-Wert normaler Milch liegt i. d. R. zwischen 6,6 und 6,8. Der im Durchschnitt häufigste Wert ist 6,7. Dieser Wert bezieht sich auf eine Messtemperatur von ca. 25 °C.
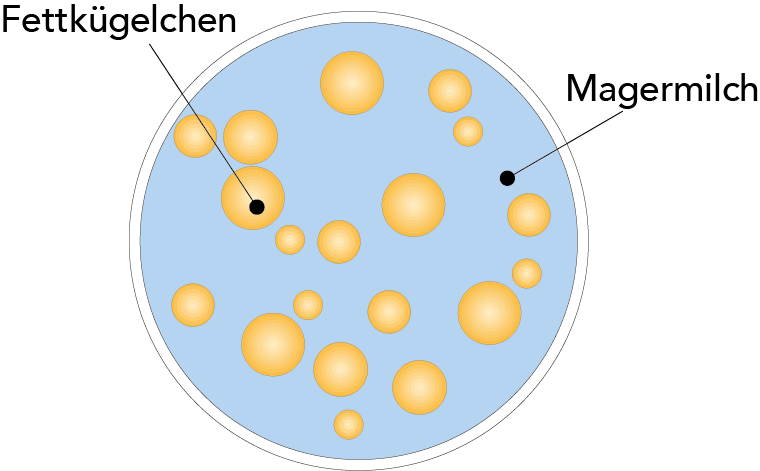
MILCHFETT
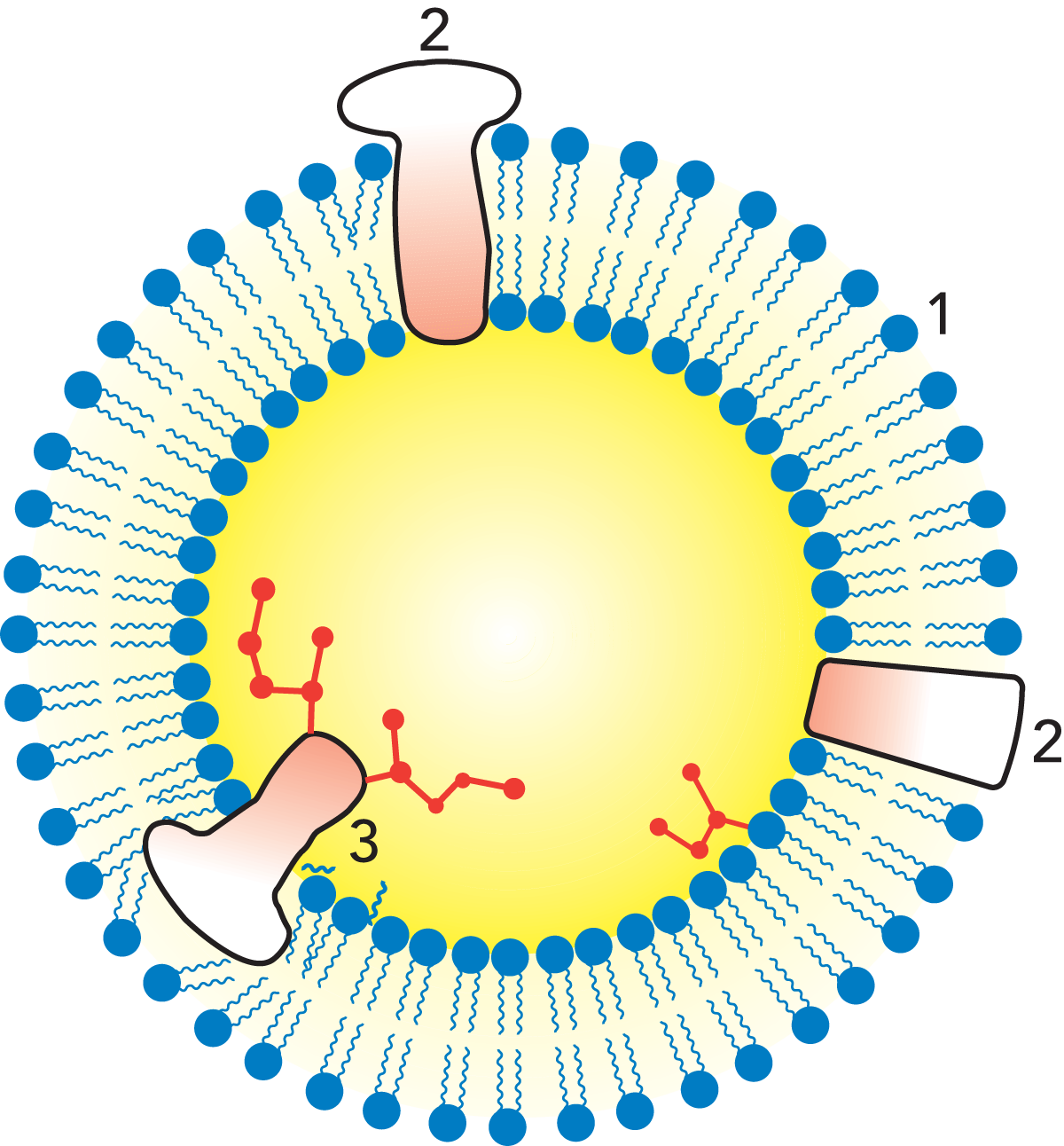
Milch und Sahne sind Beispiele für eine Fett-in-Wasser-Emulsion (oder Öl-in-Wasser- Emulsion). Das Milchfett liegt in Form kleiner Kügelchen oder Tröpfchen vor, die im Milchserum dispergiert sind (vgl. Abb. 2.15). Ihr Durchmesser variiert von 0,1 bis 20 μm (1 μm = 0,001 mm). Die Durchschnittsgröße beträgt 3 bis 4 μm, in einem Milliliter Milch befinden sich ca. 10 Milliarden Fettkügelchen.
Die Emulsion wird durch eine sehr dünne Membran von nur 10 bis 20 nm Stärke (1 nm = 10–9 m) stabilisiert, die die Kügelchen umgibt und eine komplexe Zusammensetzung hat.
Milchfett besteht aus Triglyzeriden (als dominierende Komponente), Di- und Monoglyzeriden, Fettsäuren, Sterolen, Karotinoiden (sorgen für die gelbe Färbung des Fettes), Vitaminen (A, D, E und K). Alle anderen Inhaltsstoffe, Spurenelemente, sind geringfügige Bestandteile. Die Zusammensetzung eines Milchfettkügelchens wird in Abb. 2.16 skizziert.
Die Membran der Fettkügelchen besteht aus Phospholipiden, Lipoproteinen, Cerebrosiden, Proteinen, Nukleinsäuren, Enzymen, Spurenelementen (Metalle) und gebundenem Wasser. Es sollte angemerkt werden, dass die Zusammensetzung und Dicke der Membran nicht konstant sind, da beständig Membrankomponenten mit dem umgebenden Milchserum ausgetauscht werden.
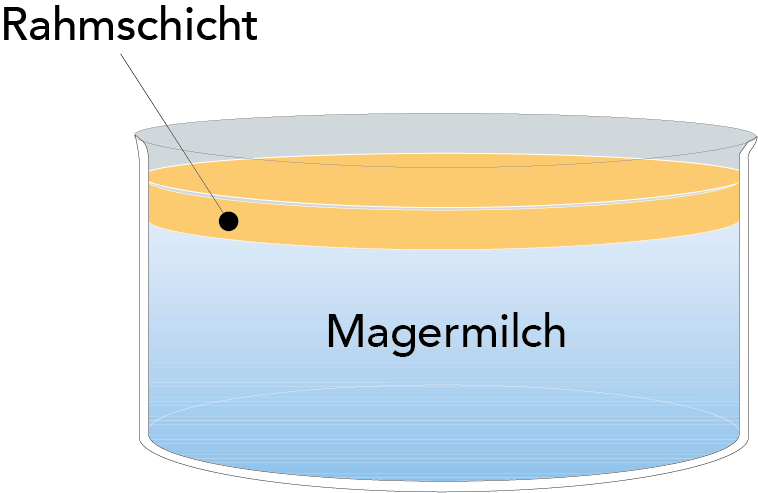
Die Fettkügelchen sind nicht nur die größten Teilchen in der Milch, sondern auch die leichtesten (Dichte bei 15,5 °C = 0,93 g/cm3), sodass sie zur Aufrahmung an die Oberfläche steigen, wenn Milch für eine Zeit in einem Gefäß steht (vgl. Abb. 2.17).
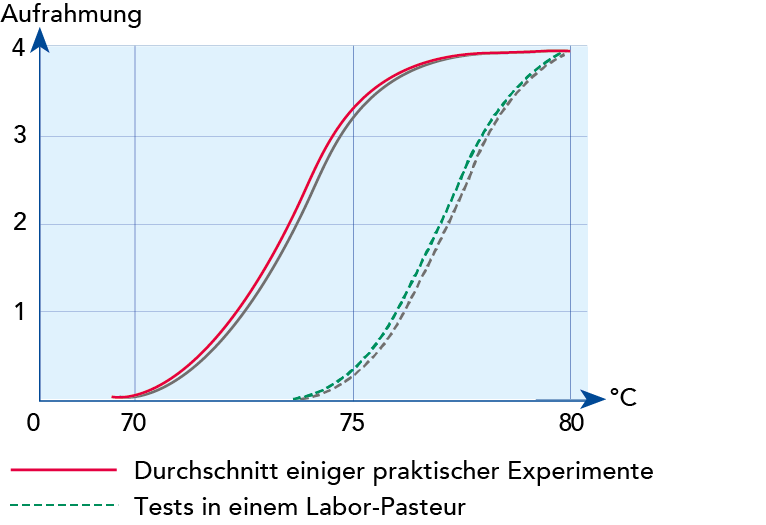
Die Auftriebsrate gehorcht dem Stoke'schen Gesetz, doch lässt die geringe Größe der Fettkügelchen das Aufrahmen zu einem langsamen Prozess werden. Das Abscheiden von Rahm kann aber durch Aneinanderlagern von Fettkügelchen unter Einfluss eines als Agglutinin bezeichneten Eiweißes beschleunigt werden. Diese Aggregate rahmen viel schneller auf als einzelne Fettkügelchen. Die Aggregate werden leicht durch Wärmeeinwirkung oder mechanische Behandlung aufgebrochen. Agglutinin wird bei Temperatur-Zeit-Kombinationen von 75 °C/2 min denaturiert, wobei im Rahm die Fähigkeit zur Aneinanderlagerung der Fettkügelchen verlorengeht.
CHEMISCHE STRUKTUR DES MILCHFETTES
Milchfett ist flüssig, wenn es das Euter bei 37 °C verlässt. Dies bedeutet, dass die Fettkügelchen leicht ihre Gestalt wechseln können, wenn sie einer schonenden mechanischen Behandlung ausgesetzt werden – z. B. durch Pumpen oder Durchfluss von Rohrleitungen –, ohne dass das Fett aus der Membran austritt.
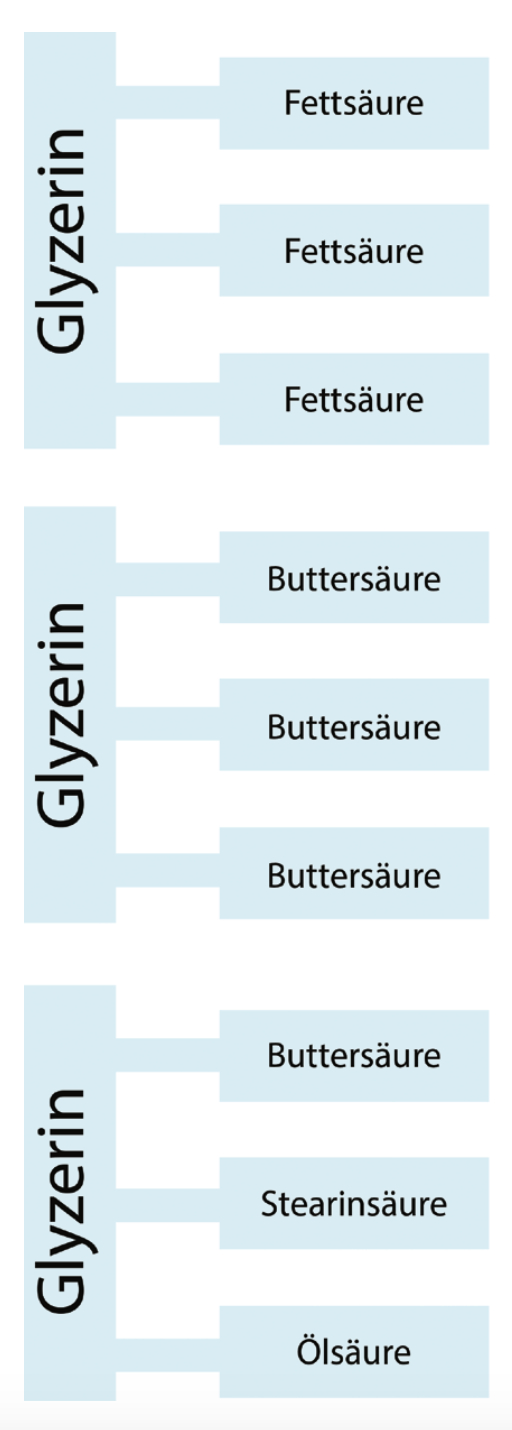
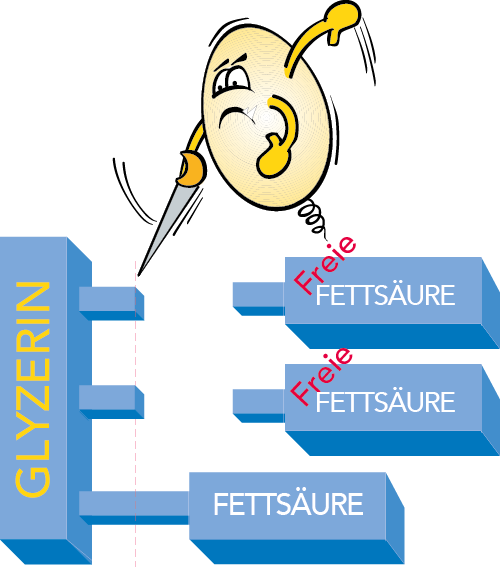
Fett gehört zur als Ester bezeichneten Gruppe chemischer Verbindungen, die Verbindungen von Alkoholen und Säuren darstellen. Milchfett ist eine Mischung verschiedener als Triglyzeride bezeichneter Fettsäureester, die sich aus einem Alkohol namens Glyzerin und verschiedenen Fettsäuren zusammensetzen. Ca. 99 % des Milchfettes besteht aus Glyzeriden.
Ein Fettsäuremolekül besteht aus einer Kohlenwasserstoffkette und einer Carboxylgruppe (Formel R-COOH). Bei gesättigten Fettsäuren sind die Atome in der Kette über Einfachbindungen gebunden, bei ungesättigten Fettsäuren befinden sich eine oder mehrere Doppelbindungen in der Kohlenwasserstoffkette (vgl. Abb. 2.19). Jedes Glyzerinmolekül kann drei Fettsäuremoleküle binden, da diese aber nicht unbedingt von gleicher Art sein müssen, kann die Zahl der in Milch vorliegenden verschiedenen Glyzeride extrem groß sein (vgl. Abb.2.20).
Tabelle 2.4 listet die wichtigsten Fettsäuren in Milchfettgylzeriden auf.
SCHMELZPUNKT DES MILCHFETTES
Tabelle 2.4 zeigt, dass Myristin-, Palmitin-, Stearin- und Ölsäure die vier häufigsten Fettsäuren in der Milch bilden.
Die ersten drei sind bei Raumtemperatur fest, die letztere flüssig. Wie die angegebenen Zahlen zeigen, können die anteiligen Mengen der verschiedenen Fettsäuren stark schwanken. Dies beeinflusst die Härte des Fettes. Fett mit einem hohen Anteil hochschmelzender Fettsäuren, wie z. B. Palmitinsäure, ist hart. Andererseits liefert Fett mit einem hohen Anteil der niedrigschmelzenden Ölsäure weiche Butter.
Die Bestimmung der Mengen an einzelnen Fettsäuren ist lediglich von wissenschaftlichem Interesse. ln der Praxis reicht es aus, eine oder mehrere Konstanten bzw. Indizes zu bestimmen, die eine gewisse Information über die Fettzusammensetzung liefern.
JODZAHL
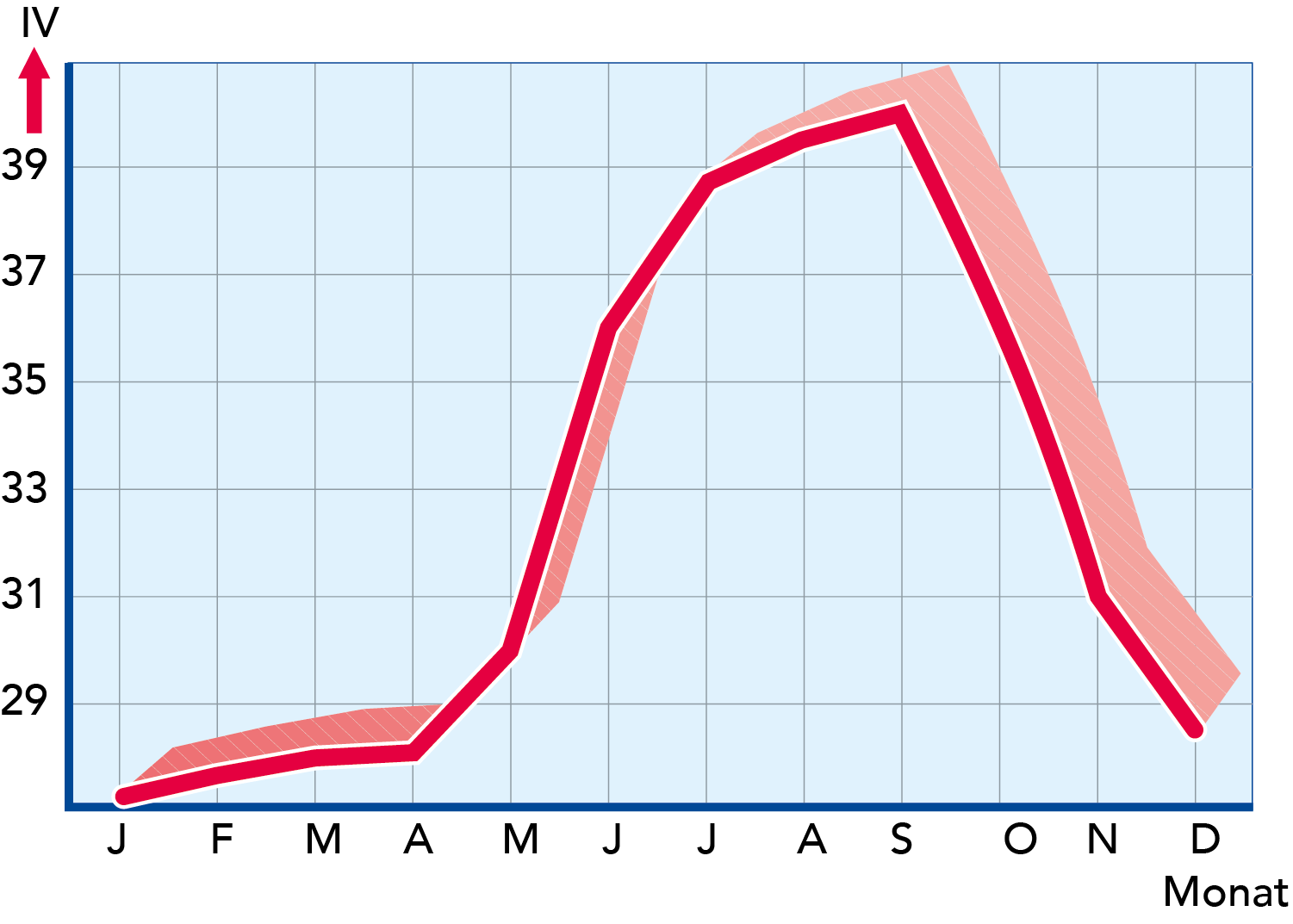
Fettsäuren mit gleicher Anzahl an C- und H-Atomen, aber verschiedener Anzahl von Einfach- und Doppelbindungen weisen unterschiedliche Charakteristiken auf. Die wichtigste und am weitesten gebräuchliche Methode, ihre spezifischen Eigenschaften aufzuzeigen, ist die Messung der Jodzahl (IV) im Fett. Die Jodzahl gibt die prozentuale Menge an Jod an, die das Fett binden kann. Jod wird an den Doppelbindungen ungesättigter Fettsäuren gebunden. Da Ölsäure die weitaus häufigste ungesättigte, bei Zimmertemperatur flüssige Fettsäure in Milchfett ist, besteht die Jodzahl vor allem in der Messung des Ölsäuregehaltes und damit der Weichheit des Fettes.
Die Jodzahl von Butterfett variiert normalerweise zwischen 24 und 46. Die Schwankungen werden vom Futter der Kuh bestimmt. Weidegras im Sommer führt zu einem hohen Ölsäuregehalt, sodass Sommermilchfett weich ist (hohe Jodzahl). Bestimmte Futterkonzentrate wie Sonnenblumen- oder Ölsaatkuchen produzieren ebenfalls weiches Fett, während andere Futtersorten wie Kokosnuss- und Palmkernkuchen oder Wurzelgemüsespitzen hartes Fett produzieren. Man kann daher die Konsistenz des Milchfettes über eine geeignete Wahl der Ernährung der Kühe beeinflussen.
Abb. 2.21 zeigt ein Beispiel für die Schwankung der Jodzahl von Milchfett im Jahresverlauf (Schweden).
Fett mit hohem Anteil an niedrigschmelzenden Fettsäuren ist weich.
REFRAKTIONSINDEX
Die Menge an verschiedenen Fettsäuren im Fett beeinflusst auch die Art, wie Licht gebrochen wird. Es ist daher gängige Praxis, den Refraktionsindex von Fett zu bestimmen, der dann zur Berechnung der Jodzahl dient. Dies bildet eine Schnellmethode zur Bewertung der Fetthärte.
NUKLEARMAGNETRESONANZ (NMR)
Anstatt die Jodzahl oder den Refraktionsindex zu bestimmen, kann auch das Verhältnis von gesättigten zu ungesättigten Fettsäuren durch gepulste NMR bestimmt werden. Ein Umrechnungsfaktor dient, falls nötig, zur Umsetzung des NMR-Wertes in eine entsprechende Jodzahl.
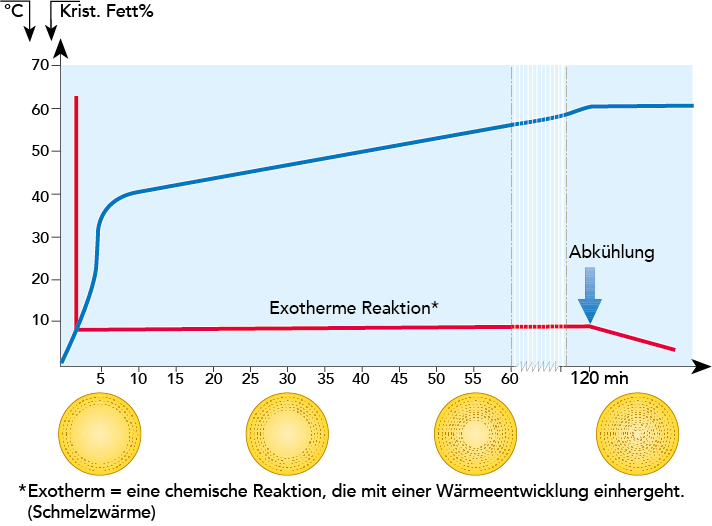
Die NMR-Methode kann auch dazu benutzt werden, um das Ausmaß der Fettkristallisation in Abhängigkeit von der Kristallisationszeit zu bestimmen. Versuche ergaben, dass die Fettkristallisation lange dauert, wenn man 40%igen Rahm von 60 °C auf 5 °C kühlt. Es ist eine Kristallisationszeit von wenigstens zwei Stunden erforderlich, um 65 % vom Gesamtfett zu kristallisieren (vgl. Abb. 2.22).
Es wurde festgestellt, dass nur 15 bis 20 % des Fettes binnen zwei Minuten nach Erreichen einer Temperatur von 5 °C auskristallisiert. Der NMR-Wert von Butterfett variiert i. d. R. zwischen 30 und 41.
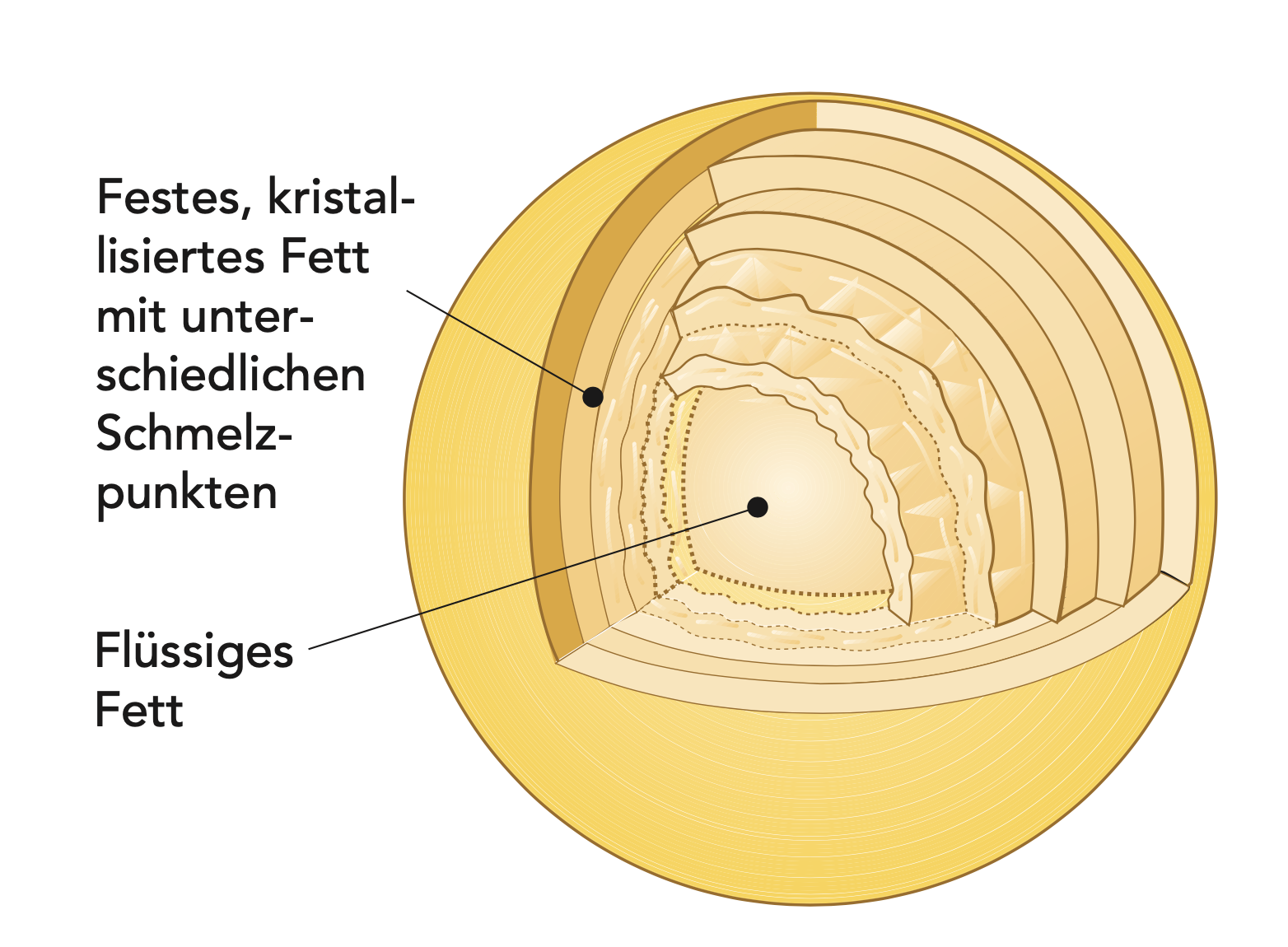
FETTKRISTALLISATION
Während des Kristallisationsprozesses sind die Fettkügelchen in einem sehr empfindlichen Zustand und brechen selbst bei schonender mechanischer Behandlung leicht auf.
Elektronenmikroskopische Untersuchungen zeigten, dass Fett in monomole- kularen Schichten kristallisiert (vgl. Abb. 2.22). Zur gleichen Zeit findet eine Fraktionierung statt, sodass die Triglyzeride mit den höchsten Schmelzpunkten die äußeren Schichten ausbilden. Da kristallisiertes Fett ein geringeres spezifisches Volumen als flüssiges Fett hat, kommt es im Inneren der Fettkügelchen zu Spannungen, was sie besonders instabil und anfällig für Aufbrechen nach der Kristallisationszeit macht. Im Ergebnis wird flüssiges Fett in das Milchserum freigesetzt, was zur Bildung von Koaleszenzen führt, da das freie Fett die unbeschädigten Fettkügelchen zusammenklebt (derselbe Prozess wird bei der Butterherstellung genutzt). Das Kristallisieren von Fett setzt Wärme frei, was die Temperatur insgesamt leicht ansteigen lässt (40%iger Rahm, der von 60 °C auf 7 bis 8 °C gekühlt wird, wird während der Kristallisationszeit um 3 bis 4 °C wärmer).
Diese wichtige Eigenschaft des Milchfettes muss bei der Herstellung von Sahne für verschiedene Verwendungszwecke unbedingt berücksichtigt werden.
MILCHPROTEINE
Milchproteine sind ein essentieller Bestandteil unserer Ernährung. Die Proteine, die wir zu uns nehmen, werden im Verdauungstrakt und in der Leber zu einfacheren Verbindungen abgebaut. Diese werden dann zu den Körperzellen transportiert, wo sie als Bausteine für körpereigenes Protein verwendet werden. Die allermeisten chemischen Reaktionen im Organismus werden von bestimmten aktiven Proteinen gesteuert, die man als Enzyme bezeichnet.
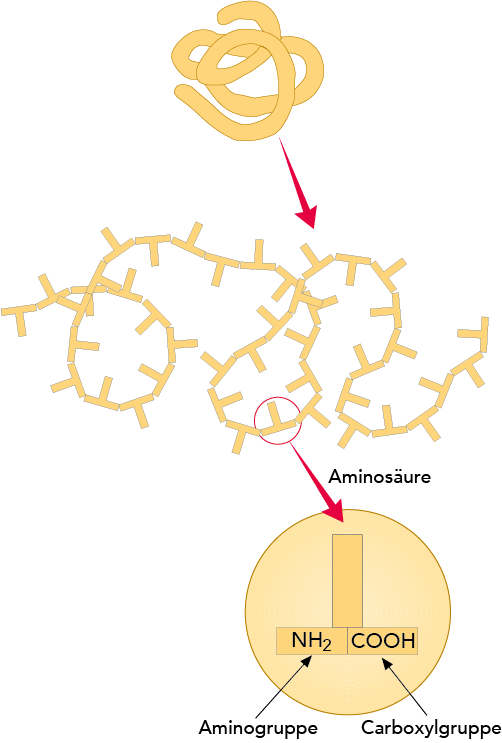
Eiweiße sind sehr große Moleküle, die sich aus kleineren, als Aminosäuren bezeichneten Bausteinen zusammensetzen (vgl. Abb. 2.23). Ein Proteinmolekül besteht aus einer oder mehreren verbundenen Ketten von Aminosäuren, in denen die Aminosäuren in einer spezifischen Reihenfolge angeordnet sind. Ein Proteinmolekül besteht i. d. R. aus ca. 100 bis 200 verbundenen Aminosäuren, es gibt aber auch Proteinmoleküle mit weniger und sehr viel mehr Aminosäuren.
AMINOSÄUREN
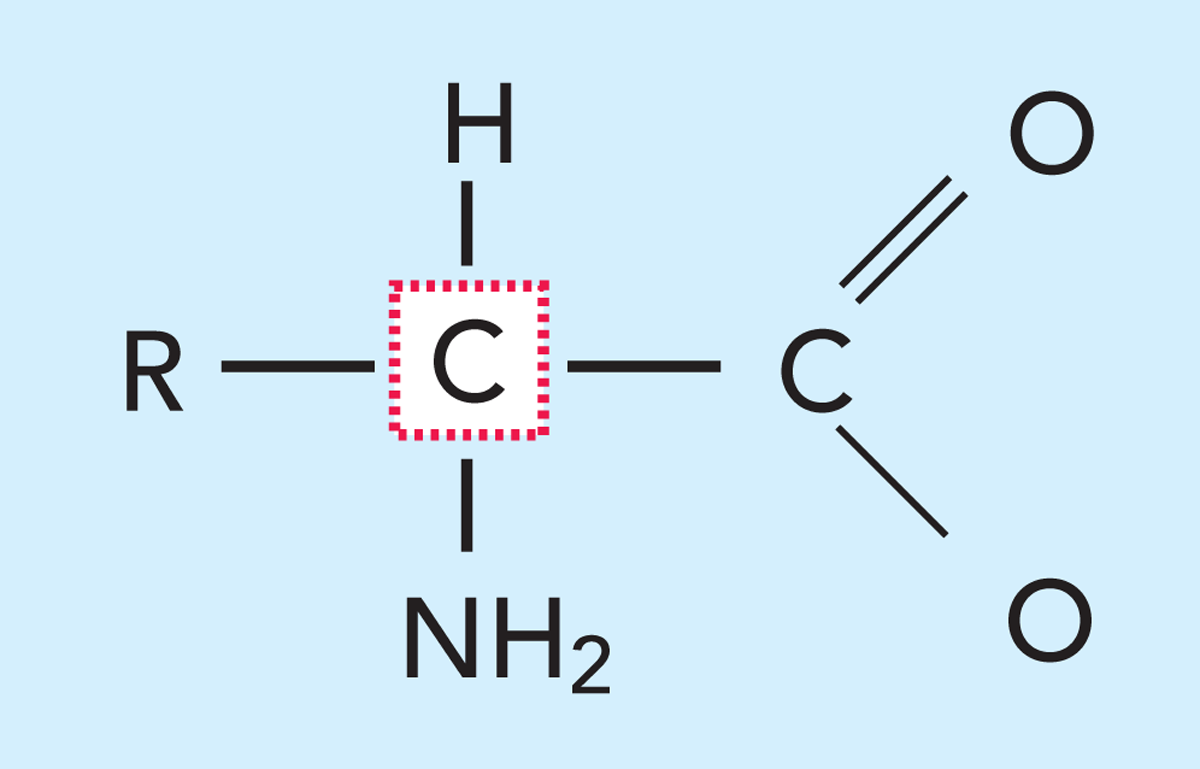
Die Aminosäuren in Abb. 2.24 bilden die Bausteine für Eiweiß und zeichnen sich durch die gleichzeitige Anwesenheit einer Aminogruppe (–NH2) und einer Carboxylgruppe
(-COOH) im Molekül aus. Eiweiße werden durch eine spezielle Art von Aminosäuren aufgebaut, den α-Aminosäuren, d. h. die sowohl eine Amino- als auch eine Carboxylgruppe am selben Kohlenstoffatom, dem α-C-Atom, besitzen. Aminosäuren gehören zu einer Gruppe chemischer Verbindungen, die in alkalischen Lösungen Wasserstoffionen abgeben und in sauren Lösungen Wasserstoffionen aufnehmen können. Solche Verbindungen werden als amphotere Elektrolyten oder Ampholyten bezeichnet.
Aminosäuren können daher in drei Formen auftreten:
- Negative geladen in alkalischen Lösungen,
- Neutral mit gleichen + und - Ladungen,
- Positiv geladen in sauren Lösungen.
Proteine bauen sich aus einem Grundbestand von 20 Aminosäuren auf. Wichtig in Bezug auf die Ernährung ist, dass acht (neun bei Säuglingen) dieser 20 Aminosäuren nicht vom menschlichen Organismus gebildet werden können. Da sie zum Erhalten des Stoffwechsels notwendig sind, müssen sie über die Nahrung zugeführt werden. Sie werden als essentielle Aminosäuren bezeichnet und finden sich allesamt in der Milch.
Art und Anordnung der Aminosäuren im Proteinmolekül bestimmen die Art des Eiweißes. Jede Veränderung der Aminosäuren bzgl. Art oder Position in der Molekülkette kann zu einem Protein mit anderen Eigenschaften führen.
Da die Anzahl der möglichen Kombinationen von 20 Aminosäuren in einer Kette von 100 bis 200 Aminosäuren sehr hoch ist, ist auch die Anzahl der Proteine mit differenzierten Eigenschaften sehr hoch. Abb. 2.24 zeigt ein Modell einer Aminosäure. Charakteristisches Merkmal von Aminosäuren ist, dass sie zugleich eine leicht basische Aminogruppe (–NH2) und eine leicht saure Carboxylgruppe (-COOH) aufweisen. Diese Gruppen sind an eine Seitenkette (R) gebunden.
Ist diese Seitenkette polar, dominieren i. d. R. die wasserbindenden Eigenschaften der basischen und sauren Gruppen und sorgen so für Wasserbindung und eine leichte Löslichkeit der Aminosäure in Wasser. Diese Aminosäuren bezeichnet man als hydrophil („wasserliebend").
Besteht die Seitenkette aber aus Kohlenwasserstoff und enthält keine hydrophilen Gruppen, dominieren die Eigenschaften des Kohlenwasserstoffs. Eine lange Kohlenwasserstoffkette stößt Wasser ab und macht die Aminosäure so weniger löslich in Wasser. Solche Aminosäuren werden als hydrophob („wasserabstoßend") bezeichnet.
Befinden sich in der Seitenkette bestimmte funktionelle Gruppen wie Hydroxyl- (- OH) oder Aminogruppen (–NH2), ändern sich die hydrophoben Eigenschaften hin zu höherer Hydrophilität. Herrschen in einem Teil des Eiweißmoleküls hydrophobe Aminosäuren vor, bekommt dieser Teil hydrophobe Eigenschaften. Eine Anhäufung hydrophiler Aminosäuren in einem anderen Teil des Moleküls geben diesem ganz ähnlich hydrophile Eigenschaften. Ein Proteinmolekül kann daher hydrophil, hydrophob, intermediär oder lokal hydrophil und hydrophob sein.
Einige Milcheiweiße zeigen große Unterschiede innerhalb der Moleküle hinsichtlich Wasserbindung. Einige sehr wichtige Eigenschaften der Proteine leiten sich von solchen Unterschieden ab.
Hydroxylgruppen in den Ketten einiger Aminosäuren im Kasein können mit Phosphorsäure verestern. Solche Gruppen befähigen das Kasein zur Bindung von Kalziumionen oder kolloidalem Calciumhydroxyphosphat, die starke Brücken zwischen den Molekülen ausbilden.
ELEKTRISCHER ZUSTAND DER MILCHPROTEINE
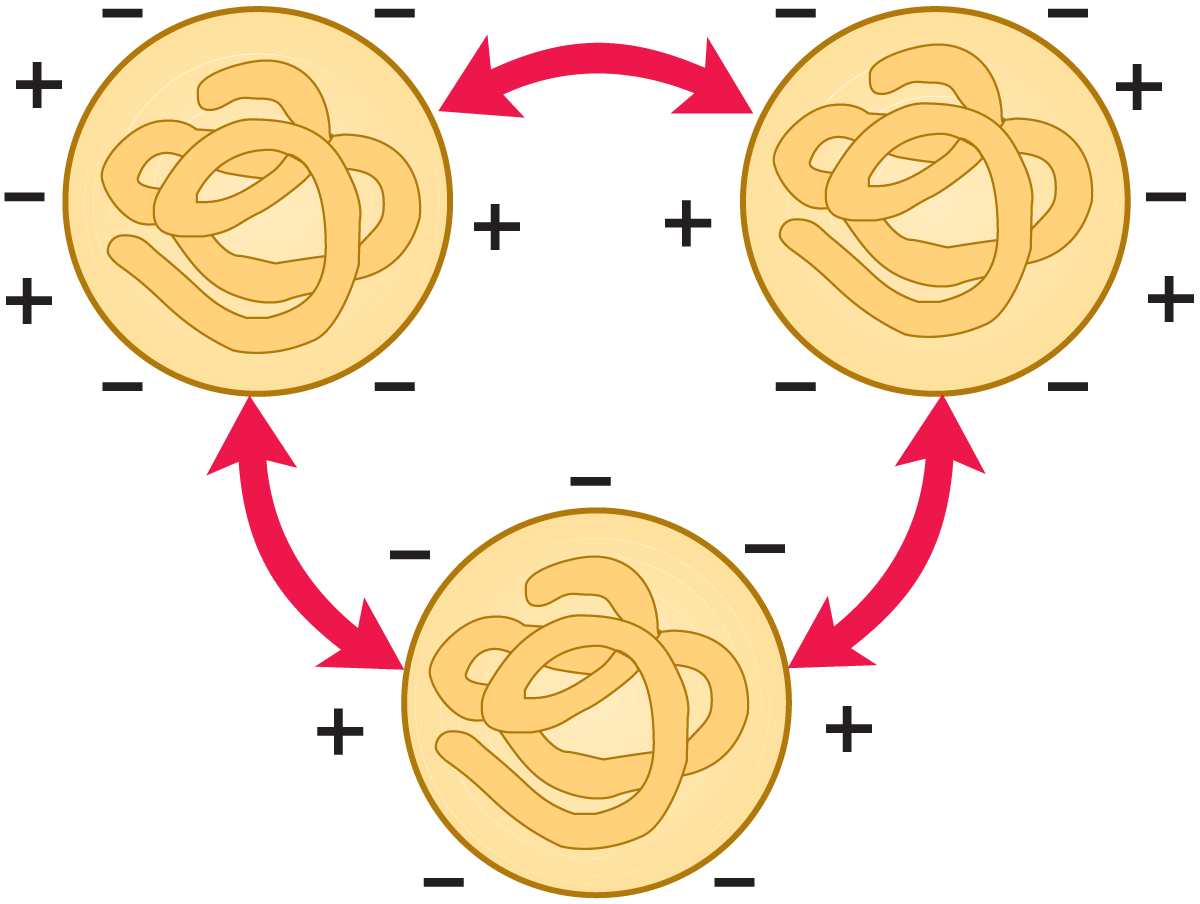
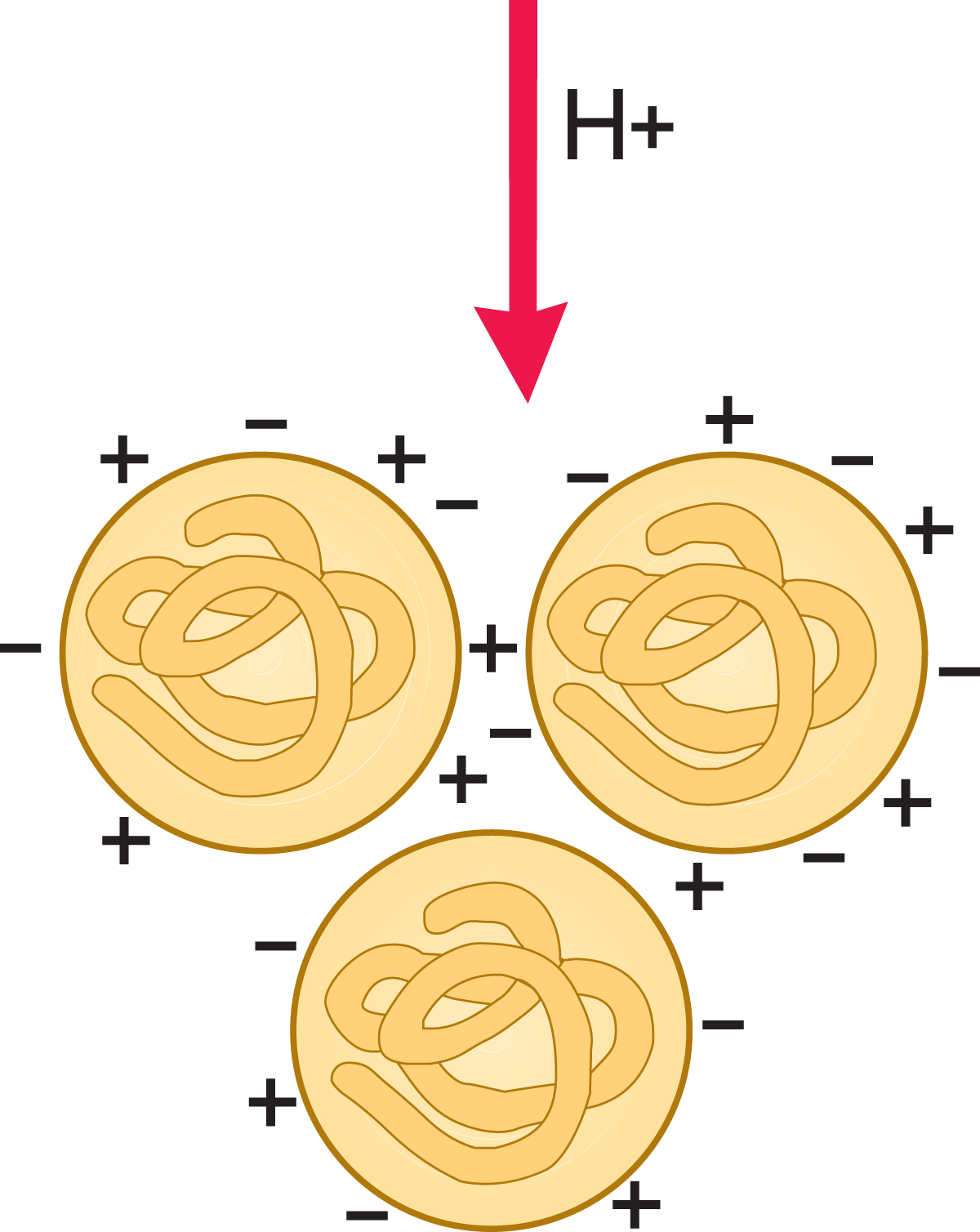
Die Seitenketten einiger Aminosäuren in Milcheiweiß tragen eine elektrische Ladung, die vom pH-Wert der Milch bestimmt wird. Wird der pH-Wert der Milch durch Zusatz von Säure oder Lauge verändert, ändert sich auch die Ladungsverteilung in den Proteinen. Der elektrische Zustand und die daraus folgenden Eigenschaften der Milcheiweiße sind in den Abb. 2.25 bis 2.28 dargestellt. Beim normalen Milch-pH-Wert von ≈ 6,6 ist ein Proteinmolekül netto negativ geladen (vgl. Abb. 2.25). Die Proteinmoleküle bleiben voneinander getrennt, da sich gleichartige Ladungen abstoßen.
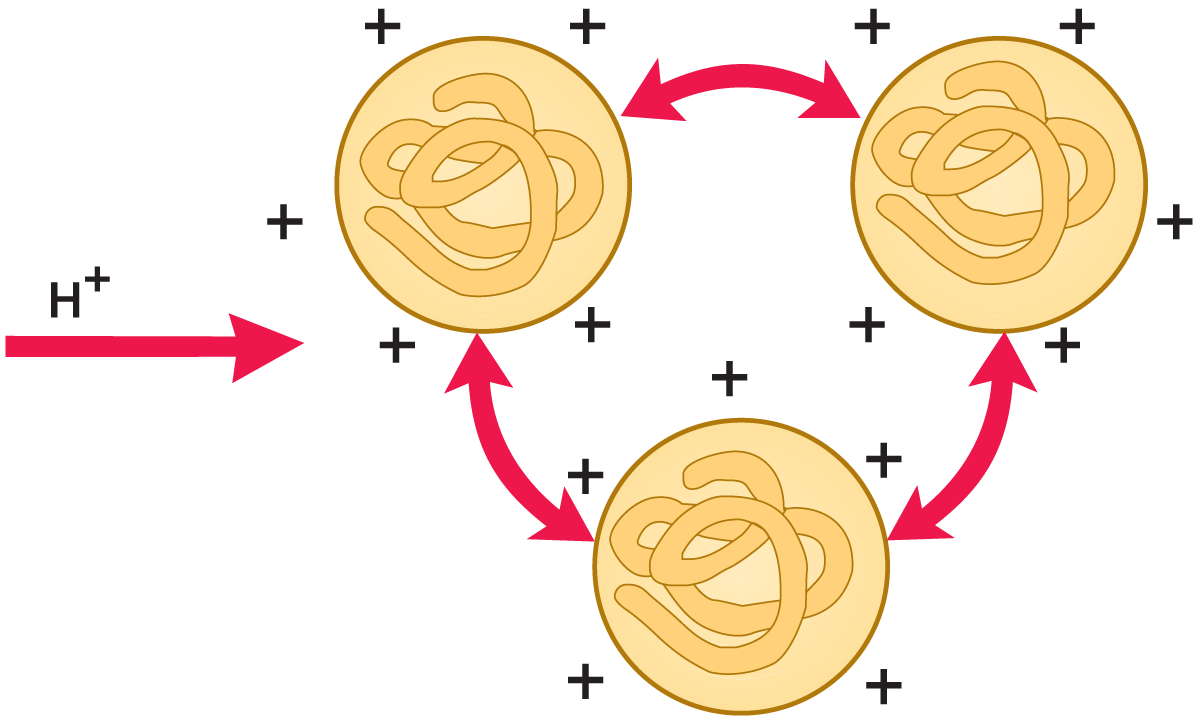
Werden Wasserstoffionen zugesetzt (vgl. Abb. 2.26), so werden sie von den Proteinmolekülen gebunden. Bei einem pH-Wert, bei dem die positive Ladung im Protein gleich der negativen ist, d. h. wenn die Anzahl der NH3+ und COO– Gruppen in den Seitenketten gleich ist, trägt das Protein eine Nettoladung von Null. Die Eiweißmoleküle stoßen sich nicht mehr gegenseitig ab, die positiven Ladungen eines Moleküls verbinden sich mit den negativen Ladungen des Nachbarmoleküls, sodass sich große Proteinaggregate bilden. Das Eiweiß wird dann aus der Lösung ausgefällt. Der pH-Wert, bei dem dies erfolgt, wird als isoelektrischer Punkt des Eiweißes bezeichnet.
Bei einem Überschuss an Wasserstoffionen erlangen die Moleküle eine netto positive Ladung (vgl. Abb. 2.27). Sie stoßen sich dann erneut gegenseitig ab und bleiben so in Lösung.
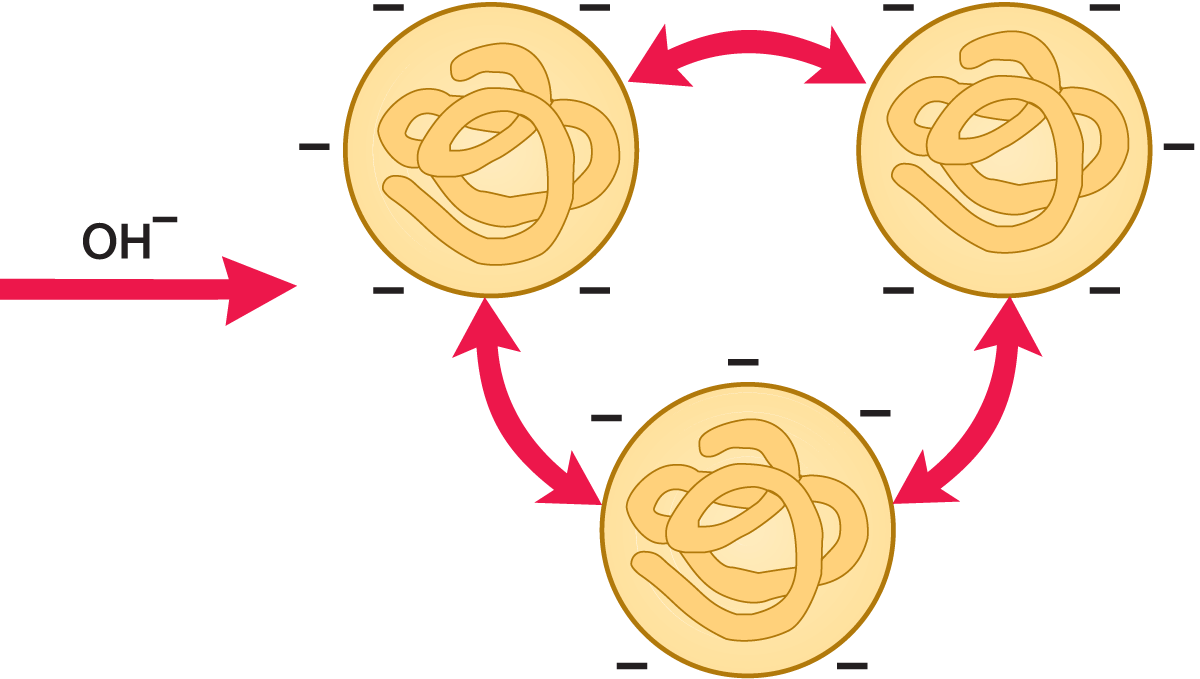
Wird dagegen eine starke Lauge (NaOH) zugesetzt, bekommen die Proteine eine negative Ladung und lösen sich auf.
KLASSIFIKATION DER MILCHEIWEISSE
Milch enthält Hunderte Arten von Proteinen, die meisten in sehr kleinen Mengen. Die Eiweiße lassen sich auf verschiedene Weise gemäß ihrer chemischen oder physikalischen Eigenschaften oder biologischen Wirkungen klassifizieren. Die alte Einteilung der Milchproteine in Kasein, Albumin und Globulin wurde zugunsten eines geeigneteren Klassifikationssystems abgelöst. Tabelle 2.5 zeigt eine verkürzte Auflistung der Milcheiweiße nach dem modernen System. Unwesentliche Proteinklassen wurden aus Gründen der Einfachheit ausgeklammert.
Der Ausdruck Molkenprotein wird oft als Synonym für Milchserumproteine benutzt, sollte jedoch für Eiweiße aus der im Käsereiprozess gewonnenen Molke reserviert werden. Molkenproteine enthalten im Vergleich zu den Serumproteinen Fragmente von Kaseinmolekülen. Einige Serumproteine sind auch im Molkeneiweiß vorhanden, jedoch in geringerer Konzentration als in der originären Milch. Dies ist auf die Hitzedenaturierung während der dem Käsereiprozess vorangehenden Pasteurisierung zurückzuführen. Die drei Hauptarten von Milchproteinen unterscheiden sich durch ihr deutlich unterschiedliches Verhalten und ihre Form. Kaseine werden auf verschiedene Weise leicht aus Milch abgeschieden, während die Serumproteine i. d. R. in Lösung bleiben. Die Membranproteine der Fettkügelchen binden sich, wie der Name schon sagt, an die Oberfläche der Fettkügelchen und werden durch enzymatische, thermische und mechanische Einflüsse, z. B. beim Verbuttern von Rahm, freigesetzt.
KASEIN
Kasein ist eine Mischung aus verschiedenen Bestandteilen (Tabelle 2.5) und mit einem Anteil von etwa vier Fünfteln die vorherrschende Eiweißart in der Milch. Es gibt vier Hauptuntergruppen des Kaseins, das αs1-Kasein, αs2-, k- und das b-Kasein, die sich alle voneinander unterscheiden und aus mehreren genetischen Varianten bestehen. Dabei unterscheiden sich die genetischen Varianten des Eiweißes nur durch einige wenige Aminosäuren.
Die Kaseine verbinden sich miteinander und bilden große Aggregate, so genannte „Mizellen". Diese Mizellen sind aus hunderten und tausenden einzelner Kaseineiweißmoleküle aufgebaut und variieren in der Größe von 50 bis 500 nm. Da die Mizellen in kolloidaler Dimension vorliegen, können sie das Licht streuen, weshalb die weiße Farbe von Magermilch größtenteils auf die Lichtstreuung durch die Kaseinmizellen zurückzuführen ist.
Kaseinmizellen
Kaseinmizellen sind für die Eigenschaften von Milch von wesentlicher Bedeutung. Sie bestimmen zu einem großen Teil die physikalische Haltbarkeit von Milchprodukten bei der Erhitzung und Lagerung und sind für die Käseherstellung und Bestimmung der rheologischen Eigenschaften von fermentierten und konzentrierten Milchprodukten von essenzieller Bedeutung.
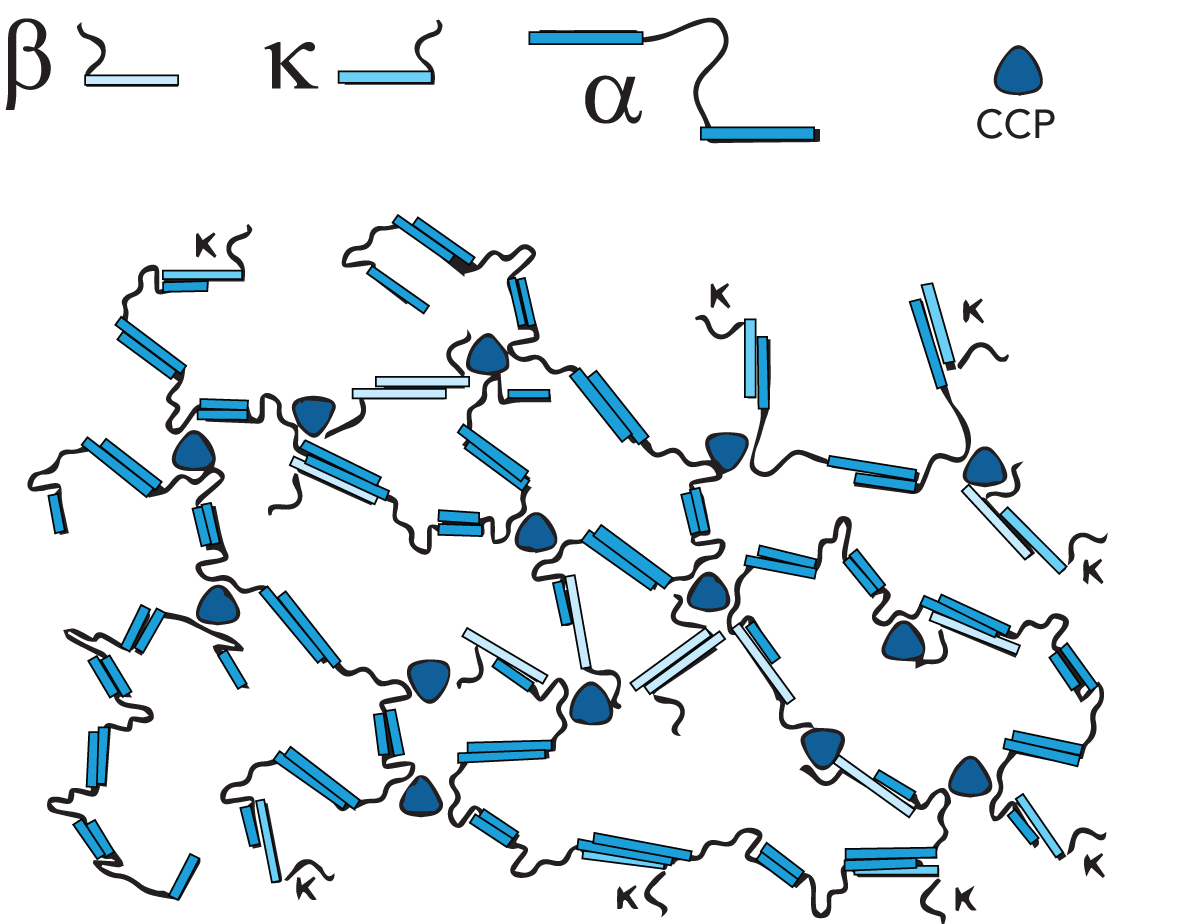
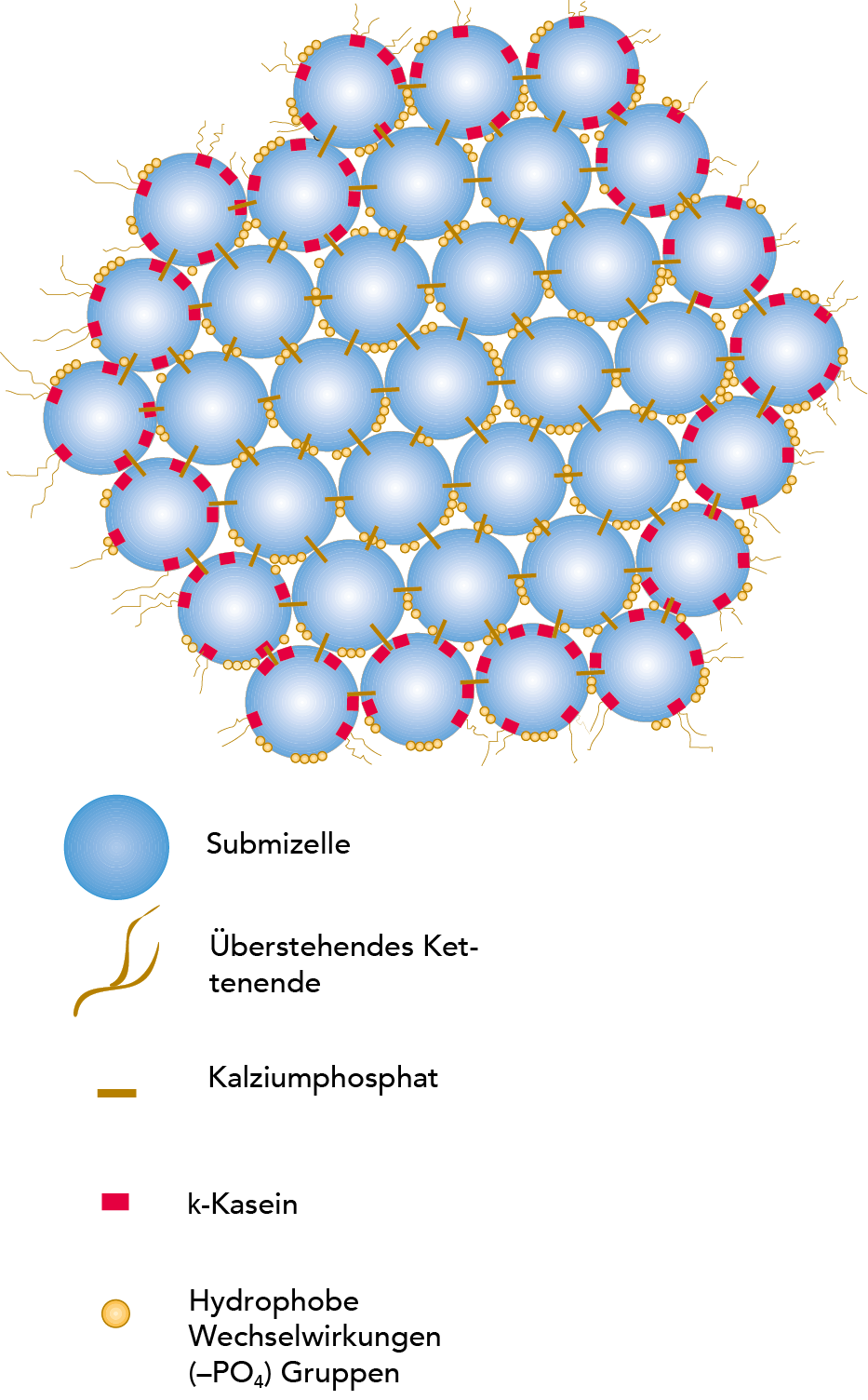
Kaseinmizellen sind relativ dichte Aggregate mit kleinen Einlagerungen von Kalziumphosphat, die die Mizellen miteinander verbinden und ihnen eine offene, poröse Struktur verleihen. Die Entfernung von Kalziumphosphat (KCP – kolloidalem Kalziumphosphat), bspw. durch Säuerung oder Zusatz von EDTA oder Zitraten, führt zur Auflösung der Mizellen. Eine Auflösung erfolgt auch bei einem über 9 liegenden ph-Wert. Die Innenstruktur der Kaseinmizelle ist seit langem Gegenstand von Diskussionen und nach wie vor nicht vollständig geklärt. Es werden drei Hauptmodelle diskutiert: das Nanocluster-Modell, das „Dual Binding"-Modell und das Submizellen-Modell.
Einigkeit besteht allerdings über die verschiedenen Eigenschaften. Bei den Mizellen handelt es sich um annähernd sphärische Teilchen mit einem durchschnittlichen Durchmesser von etwa 150 nm, deren Größenunterschied jedoch stark variiert. Die αs- und b-Kaseine konzentrieren sich hauptsächlich in der Mitte der Mizelle, wohingegen die k-Kaseine überwiegend an der Oberfläche zu finden sind. Um die Mizelle herum befindet sich eine „haarige Schicht", die hauptsächlich aus den C-Enden des k - Kaseins besteht, die 5 bis 10 nm aus der Oberfläche der Mizelle hervorragen. Die hervorstehende k -Kaseinkette ist hydrophil und negativ geladen und leistet einen wichtigen Beitrag zur sterischen Stabilität der Mizellen. Wird die haarige Schicht entfernt, z. B. durch Zusatz von Ethanol oder Hydrolyse durch Lab, wird die kolloidale Stabilität der Mizelle zerstört, die Mizellen koagulieren oder fällen aus. Darüber hinaus wird allgemein angenommen, dass es „Nanocluster" des Kalziumphosphats gibt, die rund 3 nm im Durchmesser sind und den größten Anteil des Phosphats und Kalziums in der Mizelle enthalten. Bestimmend für den Zusammenhalt der Mizelle sind durch hydrophobe Wechselwirkungen zwischen den Eiweißgruppen erzeugte Kräfte, Querverbindungen zwischen den Peptidketten durch die Nanocluster und ionische Bindungen.
Das Nanocluster-Modell (Abb. 2.29, Holt 1992, De Knuif und Holt 2003) wird als Beziehungsgeflecht flexibler Kaseinmoleküle beschrieben, die eine gelartige und durch die Kalziumphosphat-Nanocluster verbundene Struktur bilden.
Bei dem (1998) von Horne beschriebenen Dual Binding-Modell (vgl. Abb. 2.30) wird behauptet, dass die Ausgewogenheit sowohl der hydrophoben Wechselwirkungen zwischen den Kaseinmolekülen als auch die Querverbindungen mit dem kolloidalen Kalziumphosphat den Zusammenhalt der Mizelle bewirken.
Bei dem Submizellen-Modell (Morr 1967; Slattery und Evard 1973; Walstra 1999) wird vermutet, dass die Kaseinmizelle aus kleineren Mizellen, sog. Submizellen, aufgebaut ist, deren Durchmesser etwa 10 bis 15 nm beträgt, die durch Kalziumphosphat miteinander verbunden sind (vgl. Abb. 2.31).
Die Struktur einer Kaseinmizelle ist nicht fest, sondern dynamisch. Eine Kaseinmizelle tauscht jedoch Bestandteile mit ihrer Umgebung weiter aus. Sie reagiert auf Veränderungen der mizellaren Umgebung, Temperatur, des pH-Werts und Drucks.
Wird das hydrophile, überstehende Kettenende des k -Kaseins an der Mizellenoberfläche gespalten, z. B. durch Lab, verlieren die Mizellen ihre Löslichkeit. Sie beginnen sich aneinander zu lagern und ein Kaseingel auszubilden. In einer intakten Mizelle liegt ein Überschuss an negativer Ladung vor, sodass sie sich gegenseitig abstoßen. Wassermoleküle, die sich an die hydrophilen Stellen des k -Kaseins anlagern, haben einen wichtigen Anteil an diesem Gleichgewicht. Werden die hydrophilen Stellen entfernt, tritt Wasser aus der Struktur aus, sodass Anziehungskräfte zwischen den Mizellen wirken können. Es bilden sich neue Bindungen, eine vom Salztyp, wenn Kalzium beteiligt ist, die andere ist von hydrophober Natur. Diese Bindungen steigern das Austreiben von Wasser, sodass sich die Struktur am Ende zu einem festen Gel ausbildet.
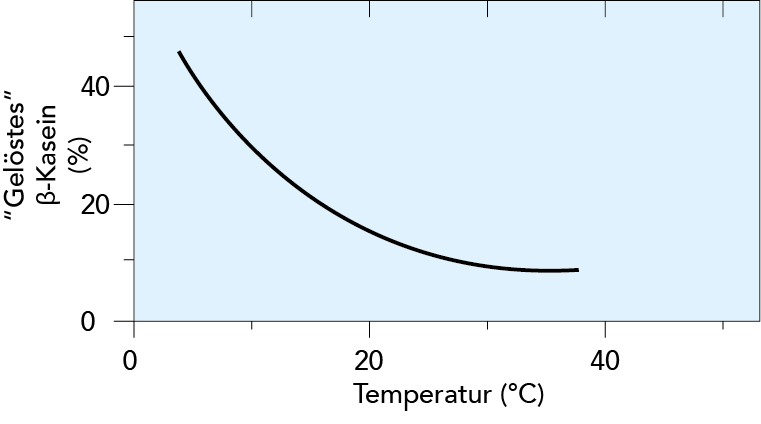
Tiefe Temperaturen beeinflussen die Mizellen negativ, da die b -Kaseinketten dissoziieren und zuvor kolloidal gelöstes KCP aus der Mizellenstruktur in die Lösung geht. Dieses Phänomen erklärt sich dadurch, dass b -Kasein das am stärksten hydrophobe Kasein darstellt und hydrophobe Wechselwirkungen bei sinkender Temperatur abnehmen. Mizellen werden dann in kleinere Teilchen zerlegt, das Volumen der Kaseinmizellen steigt an. Der Verlust an KCP führt zu schwächeren Anziehungskräften zwischen den einzelnen Kaseinmolekülen. Derartige Veränderungen verschlechtern die Tauglichkeit von Milch für die Käseherstellung, da es zu längeren Labzeiten und weicherem Bruch kommt. b-Kasein wird nach Austreten aus der Mizelle auch leichter durch verschiedene Milchproteasen hydrolysiert. Die Hydrolyse von b-Kasein in g-Kasein und Proteasepepton verringert die Käseausbeute, da die Proteasepepton-Fraktionen mit der Molke verlorengehen. Der Abbau von b-Kasein kann auch zu Bitterpeptiden führen, die in Milchprodukten für Geschmacksfehler verantwortlich sein können. Bis die Veränderungen bei 5 °C weitgehend abgeschlossen sind, dauert es etwa 24 Stunden. Die Kurve in Abb. 2.32 zeigt den Circa-Gehalt an b-Kasein in %, der binnen einer 24-stündigen Lagerung aus der Mizelle austritt. Bei einer nachfolgenden Erwärmung von Rohmilch oder pasteurisierter kalt gelagerter Milch auf 62 bis 65 °C für ca. 20 Sekunden kehren das b-Kasein und Kalziumphosphat teilweise in die Mizelle zurück, wodurch sie wenigstens teilweise die ursprünglichen Eigenschaften der Milch wiederherstellen.
Bei Erwärmung schrumpfen die Mizellen in einem gewissen Maße und der Anteil an KCP steigt an. Während der Erhitzung gehen vorhandene Serumproteine bei der Hitzedenaturierung auf Kaseinmizellen über und binden sich zum großen Teil an der Mizellenoberfläche. Ein Beispiel ist die Bindung von b-Laktoglobulin und k-Kasein während der Erhitzung. Die meisten dieser Bindungen sind nicht kältereversibel.
Ausfällung von Kasein
Eine charakteristische Eigenschaft von Kasein ist, dass es ausgefällt werden kann. Wegen der komplexen Beschaffenheit der Kaseinmoleküle und der daraus gebildeten Mizellen kann die Ausfällung durch viele verschiedene Agentien ausgelöst werden. Es wurde festgestellt, dass bei optimalen Ausfällungsbedingungen für Kasein in mizellärer und nicht mizellärer Form, z. B. als Natriumkaseinat, große Unterschiede bestehen. Die folgende Beschreibung bezieht sich u. a. auf die Ausfällung mizellären Kaseins.
- Ausfällung durch Säure und
- Ausfällung durch Enzyme
Ausfällung durch Säure
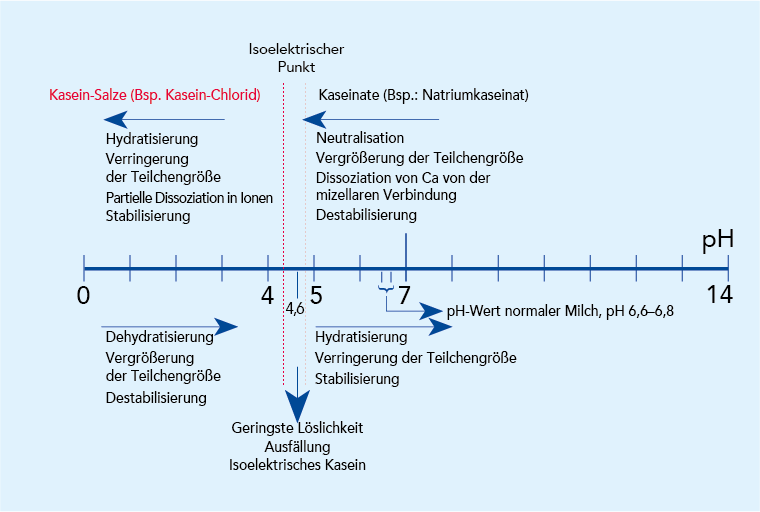
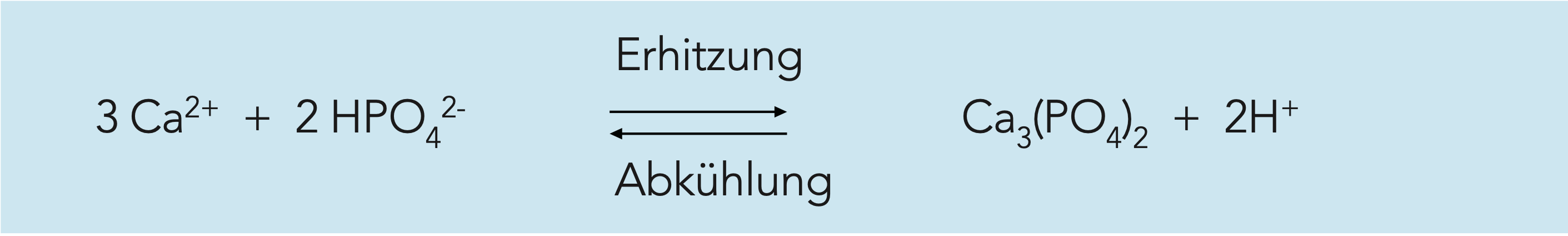
Wird der Milch Säure zugesetzt oder wachsen in ihr säurebildende Mikroorganismen, sinkt der pH-Wert. Dies beeinflusst die Umgebung der Kaseinmizellen auf zwei Weisen. Die Auswirkungen sind in Abb. 2.33 beschrieben. Zunächst löst sich das in der Kaseinmizelle vorhandene KCP und bildet ionisiertes Kalzium, das die Mizellenstruktur durchdringt und starke interne Kalziumbindungen aufbaut. Danach nähert sich der pH-Wert der Lösung den isoelektrischen Punkten der einzelnen Kaseinarten.
Beides löst eine Veränderung in den Mizellen aus, angefangen von einem Wachsen der Mizellen durch Aggregation und endend bei einem mehr oder weniger dichten Koagulum. Abhängig vom End-pH-Wert enthält dieses Koagulum entweder Kasein in Salzform oder Kasein am isoelektrischen Punkt, oder aber beides.
Die isoelektrischen Punkte der Kaseinbestandteile hängen von anderen in der Lösung vorhandenen Ionen ab. Theoretische Werte, die unter bestimmten Bedingungen gelten, sind pH 5,1 bis 5,3. In salzigen Lösungen, ähnlich originärer Milch, liegt das Optimum für die Ausfällung bei pH 4,5 bis 4,9. Ein Praxiswert für die Ausfällung von Kasein aus Milch wäre pH 4,6.
Wird Natronlauge in hohem Überschuss zum ausgefällten isoelektrischen Kasein gegeben, wird das wieder aufgelöste Kasein in Natriumkaseinat überführt, das z. T. in Ionen dissoziiert. Der pH-Wert gesäuerter Milchprodukte liegt meist bei 3,9 bis 4,5, also auf der sauren Seite der isoelektrischen Punkte. Bei der Kaseinproduktion aus Magermilch durch Zusatz von Schwefel- oder Salzsäure wird der pH-Wert oft auf 4,6 eingestellt.
Ausfällung durch Enzyme
Die Aminosäurekette, aus der sich das k-Kaseinmolekül bildet, besteht aus 169 Aminosäuren. Aus enzymatischer Sicht ist die Bindung zwischen den Aminosäuren Nr. 105 (Phenylalanin) und 106 (Methionin) für viele proteolytische Enzyme leicht zugänglich.
Einige proteolytische Enzyme greifen diese Bindung an und spalten so die Kette. Das lösliche Kettenende enthält die Aminosäuren 106 bis 169, die stark von polaren Aminosäuren und Kohlenhydraten geprägt sind und dieser Sequenz hydrophile Eigenschaften verleihen. Dieser Teil des k -Kaseinmoleküls wird als Glycomacropeptid bezeichnet und geht während der Käseherstellung in die Molke über.
Der verbleibende Teil des k -Kaseinmoleküls, das Para-Kappa-Kasein, besteht aus den Aminosäuren Nr. 1 bis 105, ist unlöslich und verbleibt zusammen mit dem αs- und b -Kasein im Koagulum. Das Gesamtkasein ohne Glycomacropeptid bezeichnet man als Para-k-Kasein.
Die Bildung des Koagulums erfolgt nach dem schnellen Entfernen der hydrophilen Makropeptide und dem dadurch ausgelösten Ungleichgewicht bei den zwischenmolekularen Kräften. Zwischen hydrophoben Stellen bilden sich Bindungen aus, die durch Kalziumbrücken verstärkt werden, sobald Wassermoleküle die Mizellenstruktur verlassen. Dieser Prozess wird meist als Dicklegungs- und Synäresephase bezeichnet.
Das Spalten der Bindung 105 - 106 im k-Kaseinmolekül wird oft als Primärphase der Labwirkung bezeichnet, während die Koagulations- und Synäresephase als zweite Labphase bezeichnet wird. Es gibt auch noch eine dritte Labphase, in der das Enzym die Kaseinbestandteile generell angreift. Dies erfolgt während der Käsereifung.
Die Dauer jeder der drei Phasen wird u. a. durch pH-Wert und Temperatur bestimmt. Zudem wird die zweite Phase stark von der Kalziumionenkonzentration und dem Zustand der Mizellen hinsichtlich Vorkommen oder Fehlen denaturierter Milchserumproteine auf den Mizellenoberflächen beeinflusst.
MOLKENPROTEINE
Molkenprotein ist die gängige Bezeichnung für Milchserumproteine.
Wird Kasein aus Magermilch durch eine Ausfällmethode entfernt, z. B. den Zusatz von Mineralsäuren, verbleibt eine Gruppe von Eiweißen in Lösung, die als Milchserumproteine bezeichnet werden. Solange diese nicht durch Hitze denaturiert werden, fallen sie an ihren isoelektrischen Punkten nicht aus.
Wird Milch erhitzt, denaturiert ein Teil der Molkenproteine und bildet Komplexe mit dem Kasein aus, wodurch sich die Angreifbarkeit des Kaseins für Lab und seine Kalziumbindungsfähigkeit ändern. Bruch aus hoch erhitzter Milch gibt als Folge einer geringeren Anzahl an Kaseinbrücken in und zwischen den Kaseinmolekülen nicht wie gewöhnlicher Käsebruch Molke ab.
Molkenprotein im Allgemeinen und α-Laktalbumin im Besonderen weisen einen hohen ernährungsphysiologischen Wert auf. Ihre Aminosäurezusammensetzung ist sehr nah am biologischen Optimum. Molkenproteinderivate werden in der Lebensmittelindustrie in großem Umfang verwendet.
α-Lactalbumin
Dieses Eiweiß gilt als das typische Molkenprotein. Es ist in der Milch aller Säugetiere vorhanden und spielt bei der Laktosesynthese im Euter eine wichtige Rolle.
ß-Lactoglobulin
Dieses Eiweiß findet sich nur bei Huftieren und bildet den Hauptmolkenproteinanteil in Kuhmilch. Wird Milch auf über 60 °C erhitzt, kommt es zur Denaturierung, bei der die Reaktivität der Schwefel-Aminosäuren in b-Laktoglobulin eine wichtige Rolle spielt. Schwefelbrücken bilden sich zwischen den b-Laktoglobulinmolekülen aus, zwischen einem b-Laktoglobulinmolekül und einem k-Kaseinmolekül sowie zwischen b-Laktoglobulin und α-Laktalbumin. Bei hohen Temperaturen werden allmählich Schwefelverbindungen wie Schwefelwasserstoff frei. Diese Schwefelverbindungen sind für den Kochgeschmack wärmebehandelter Milch verantwortlich.
α-Lactalbumin
β-Lactoglobulin
Serumalbumin und
Immunoglobulin
Immunoglobuline und ähnliche weniger bedeutende Proteine
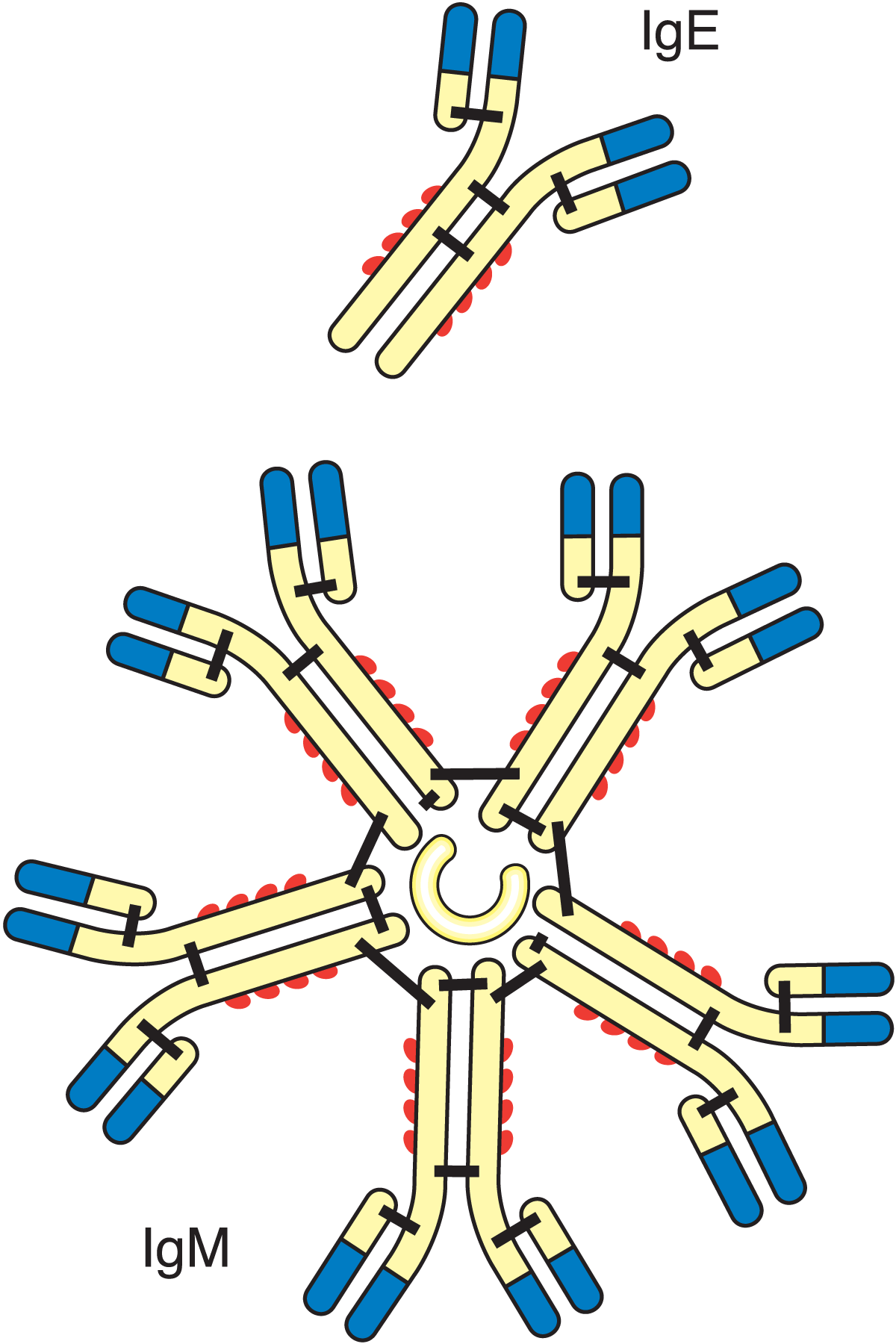
Diese Eiweißgruppe ist extrem heterogen zusammengesetzt, nur wenige darunter fallende Eiweiße wurden im Detail untersucht (vgl. Abb. 2.34).
Immunoglobuline sind Antikörper, die in Reaktion auf spezifische Antigene synthetisiert werden. Sie finden sich speziell im Blut. Ihr Gehalt in Kuhmilch ist sehr klein, aber einige davon finden sich in größeren Mengen im Kolostrum oder in Humanmilch. Sie können auch gegen „Partikel" wie Bakterien, Viren und sogar Fettkügelchen wirken und diese ausflocken lassen, eine Reaktion, die man als Agglutination bezeichnet. Auf diesem Weg können Bakterien zusammen mit Fettkügelchen ausflocken und sich in der Rahmschicht anreichern. Werden Mikroorganismen ausgeflockt, können ihr Wachstum und ihre Aktivität signifikant beeinträchtigt werden.
Die Agglutinierungsreaktion ist spezifisch in Bezug auf ein bestimmtes Antigen. Einige Agglutinierungen erfolgen aber unspezifisch, u. a. bei der sog. Kryopräzipitation - Agglutination, die in unter 37 °C gekühlter Milch erfolgt. Die daran beteiligten Proteine werden als Kryoglobuline bezeichnet. Die Agglutinine werden durch Erhitzen und hohe mechanische Belastung inaktiviert, ihre Fähigkeit zur Ausflockung verschwindet. In pasteurisierter Milch kommt es daher nicht mehr zur Agglutination.
In Zukunft werden wahrscheinlich viele wichtige Substanzen im kommerziellen Maßstab aus Milchserum oder Molke isoliert werden. Laktoferrin und Laktoperoxidase sind Stoffe, die sich zur Verwendung in der Pharma- und Lebensmittelindustrie eignen und bereits industriell aus Molke isoliert werden. Laktoferrin inhibiert (hemmt) auch Bakterien, B. stearothermophilus und B. subtilis eingeschlossen. Diese Inhibition erfolgt durch Entfernen von Eisen aus dem Serum.
MEMBRANPROTEINE
Membranproteine bilden eine Gruppe von Eiweißen, die eine Schutzschicht um Fettkügelchen ausbilden und so die Emulsion stabilisieren (vgl. Abb. 2.35). Ihre Konsistenz reicht von weich und gelatineartig bis hin zu relativ zäh und fest. Einige dieser Eiweiße enthalten Fettreste und werden als Lipoproteine bezeichnet. Die Lipide und die hydrophoben Aminosäuren dieser Proteine veranlassen die Moleküle dazu, ihre hydrophobe Seite zur Fettoberfläche hin auszurichten, während die weniger hydrophoben Seiten sich zum Wasser hin orientieren.
Schwach hydrophobe Membranproteine greifen diese Eiweißschichten auf dieselbe Weise an und bilden so einen Hydrophobiegradienten von der Fettoberfläche zum Wasser hin aus.
Der Hydrophobiegradient einer solchen Membran macht sie zur ideal geeigneten Adsorptionsstelle für alle möglichen hydrophoben Moleküle. Phospholipide und speziell lipolytische Enzyme werden in der Membranstruktur adsorbiert. Solange die Struktur intakt ist, kommt es zu keinen Reaktionen zwischen Enzym und Substrat. Sobald die Struktur jedoch zerstört ist, können die Enzyme an ihre Substrate gelangen und Reaktionen starten.
Ein Beispiel für eine enzymatische Reaktion ist die lipolytische Freisetzung von Fettsäuren, wenn kalte Milch über eine fehlerhafte Pumpe gefördert wird oder wenn kalte Milch homogenisiert wird, ohne dass sofort eine Pasteurisierung erfolgt. Die Fettsäuren und einige andere Produkte der enzymatischen Reaktion geben dem Produkt einen ranzigen Geschmack.
DENATURIERTES EIWEISS
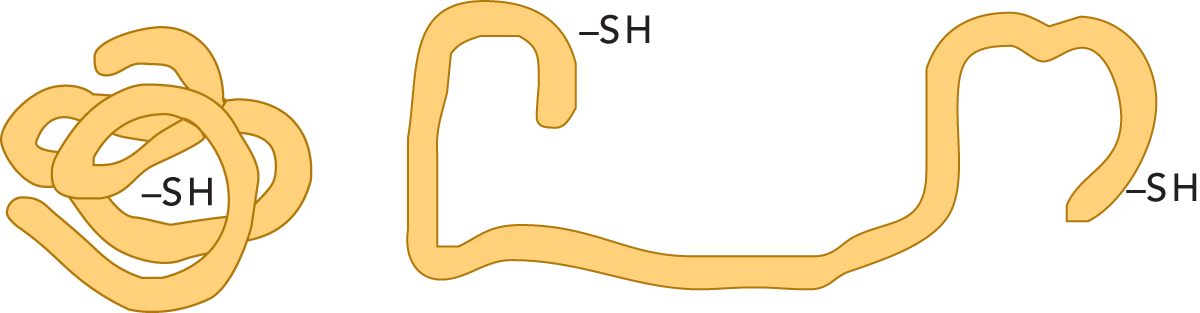
So lange Eiweiße in einer Umgebung sind, die in ihrer pH- und Hitzetoleranz liegt, behalten sie ihre biologischen Funktionen. Werden sie aber über eine bestimmte Maximaltemperatur erhitzt, verändert sich ihre Struktur. Man spricht dann von Denaturierung (vgl. Abb. 2.36). Dasselbe geschieht, wenn man Proteine Säuren oder Laugen, Strahlung oder hohem Druck aussetzt. Die Proteine denaturieren und verlieren ihre ursprüngliche Löslichkeit.
Werden Proteine denaturiert, verlieren sie ihre biologische Aktivität. Enzyme, eine Eiweißgruppe, deren Funktion in der Katalyse von Reaktionen besteht, verlieren diese Funktion beim Denaturieren. Grund dafür ist, dass bestimmte Bindungen im Molekül gespalten werden und sich so die Struktur des Eiweißes verändert. Bei nur schwacher Denaturierung können Eiweiße manchmal zu ihrem originären Zustand zurückfinden, wobei ihre biologischen Funktionen wiederhergestellt werden.
In vielen Fällen ist eine Denaturierung jedoch irreversibel. Die Eiweiße in einem gekochten Ei können z. B. nicht mehr in den rohen Urzustand zurückversetzt werden.
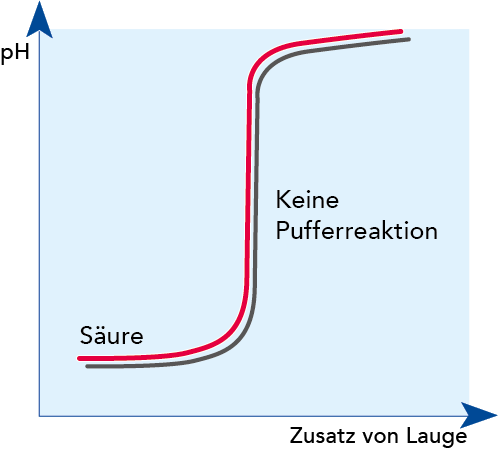
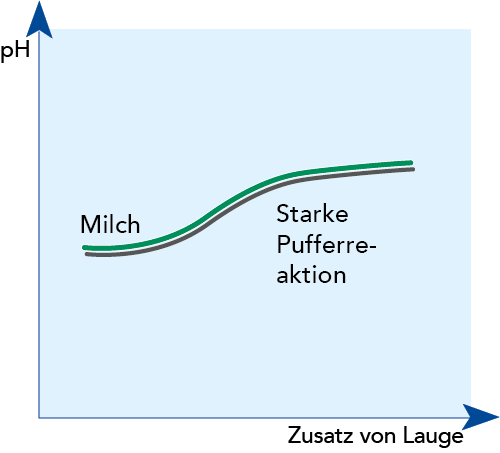
MILCH ALS PUFFERLÖSUNG
Milch enthält eine große Zahl an Stoffen, die als schwache Säuren oder Basen agieren können, z. B. Milchsäure, Zitronensäure und Phosphorsäure und deren Salze (Laktate, Zitrate, Phosphate). In der Chemie bezeichnet man ein solches System als Puffer, da der pH-Wert bei Zusatz von Säuren oder Laugen in gewissen Grenzen konstant bleibt. Dieser Effekt lässt sich über die charakteristischen Eigenschaften der Proteine erklären.
Werden Wasserstoffionen (H+) in großer Zahl frei- oder zugesetzt, wird Milch gesäuert. Diese Ionen werden nahezu vollständig an die Aminogruppen in den Seitenketten der Aminosäuren unter Bildung von NH3+-Ionen gebunden. Der pH-Wert wird jedoch davon kaum beeinflusst, da der Anstieg der Konzentration freier Wasserstoffionen sehr gering bleibt.
Wird der Milch eine Lauge zugesetzt, werden die Wasserstoffionen (H+) in den COOH-Gruppen der Seitenketten freigesetzt, wodurch sich eine COO-Gruppe bildet. Deswegen bleibt der pH-Wert mehr oder minder konstant (vgl. Abb. 2.38). Je mehr Lauge zugegeben wird, desto mehr Wasserstoffionen werden frei.
Andere Milchbestandteile können ebenso Ionen binden oder freisetzen, sodass sich der pH-Wert bei Zusatz von Säuren oder Laugen nur langsam ändert.
In Milch, die nach langer Lagerung bei hoher Temperatur bereits sauer ist, wird fast die gesamte Pufferkapazität genutzt. In diesem Fall ist dann nur eine geringe Säurezugabe nötig, um den pH-Wert zu verändern.
ENZYME IN DER MILCH
Enzyme sind Eiweiße, die die Fähigkeit besitzen, chemische Reaktionen auszulösen und den Verlauf und die Geschwindigkeit solcher Reaktionen zu beeinflussen. Enzyme gehen nach Abschluss der Reaktion wieder in ihren Ausgangszustand über. Sie werden daher manchmal auch als Biokatalysatoren bezeichnet. Die Funktion eines Enzyms wird in Abb. 2.39 veranschaulicht.
Die Wirkung eines Enzyms ist spezifisch; jede Enzymart katalysiert nur eine Reaktionsart. Zwei Faktoren, die eine enzymatische Reaktion stark beeinflussen, sind Temperatur und pH-Wert. In der Regel zeigen Enzyme in einem optimalen Temperaturbereich zwischen 25 bis 50 °C die höchste Aktivität.
Ihre Aktivität sinkt ab, wenn die Temperatur über das Optimum steigt und hört zwischen 50 und 120 °C ganz auf. Bei diesen Temperaturen werden Enzyme mehr oder weniger vollständig denaturiert (inaktiviert). Die Inaktivierungstemperatur variiert je nach Enzym – eine Gegebenheit, die man sich zum Ermitteln des Pasteurisierungsgrades von Milch häufig zu Nutze macht. Enzyme besitzen auch optimale pH-Bereiche, einige arbeiten am besten in saurer, andere am besten in alkalischer Umgebung.
Die Enzyme in der Milch stammen entweder aus dem Kuheuter oder von Bakterien. Erstere sind normale Milchbestandteile und werden als originäre Enzyme bezeichnet. Letztere, die bakteriellen Enzyme, variieren in Art und Menge je nach Typ und Ausmaß der bakteriellen Besiedlung. Einige der Milchenzyme dienen der Qualitätskontrolle und -erfassung. Die bedeutendsten darunter sind Peroxidase, Katalase, Phosphatase und Lipase.
PEROXIDASE
Peroxidase bringt Sauerstoff aus Wasserstoffperoxid (H2O2) zu anderen leicht oxidierbaren Stoffen. Dieses Enzym wird inaktiviert, wenn man Milch für einige Sekunden auf 80 °C erhitzt; dies kann man sich wiederum zu Nutze machen, um die Milch auf Vorhandensein von Peroxidase zu untersuchen und so zu überprüfen, ob eine Pasteurisierungstemperatur von über 80 °C erreicht wurde. Dieser Test wird als Peroxidasetest nach Storch bezeichnet.
KATALASE
Katalase spaltet Wasserstoffperoxid in Wasser und freien Sauerstoff. Durch Bestimmung des Sauerstoffgehaltes, den das Enzym in Milch freisetzen kann, kann man auf den Katalasegehalt der Milch und darauf rückschließen, ob die Milch von einem eutergesunden Tier stammt. Milch aus kranken Eutern hat einen hohen Katalasegehalt, während frische Milch aus einem gesunden Euter nur einen unbedeutenden Katalasegehalt aufweist. Es gibt jedoch viele Bakterien, die dieses Enzym produzieren. Katalase wird durch Erhitzen auf 75 °C für 60 Sekunden inaktiviert.
PHOSPHATASE
Phosphatase kann bestimmte Ester der Phosphorsäure in Phosphorsäure und den betreffenden Alkohol spalten. Das Vorhandensein von Phosphatase in Milch kann durch Zusatz eines Phosphorsäureesters und eines bei Reaktion mit dem freigesetzten Alkohol farbumschlagenden Reagens ermittelt werden. Ein Farbwechsel ergibt, dass die Milch Phosphatase enthält.
Phosphatase wird bei der normalen Pasteurisierung (72 bis 75 °C für 15 bis 20 Sekunden) zerstört, sodass sich der Phosphatasetest zur Bestätigung einer ordnungemäßen Pasteurisation einsetzen lässt. Der dafür in Molkereien routinemäßig eingesetzte Test ist der Phosphatasetest nach Scharer.
Der Phosphatasetest sollte vorzugsweise sofort nach der Erhitzung erfolgen. In anderen Fällen muss die Milch auf unter + 5 °C gekühlt und bei dieser Temperatur bis zur Untersuchung aufbewahrt werden. Der Test sollte am selben Tag erfolgen, ansonsten kann es zu einem als Reaktivierung bezeichneten Phänomen kommen, d. h. ein inaktiviertes Enzym wird wieder aktiv und ergibt so eine positive Testablesung. Rahm ist in dieser Hinsicht besonders empfindlich.
LIPASE
Lipase spaltet Fett in Glyzerin und freie Fettsäuren (vgl Abb 2.40). Ein Überschuss an freien Fettsäuren verursacht in Milch und Milchprodukten einen ranzigen Geschmack. Die Aktivität dieses Enzyms scheint in den meisten Fällen sehr schwach zu sein, wenn auch die Milch bestimmter Kühe eine hohe Lipaseaktivität zeigen kann. Die Lipasemenge scheint in der Milch gegen Ende des Laktationszyklus anzusteigen. Lipase wird zum großen Teil durch Pasteurisierung inaktiviert. Zur völligen Inaktivierung müssen jedoch höhere Temperaturen angewendet werden. Viele Mikroorganismen produzieren Lipasen. Dies kann gravierende Probleme verursachen, da diese Enzyme sehr hitzestabil sind.
LAKTOSE IN DER MILCH
Laktose ist ein Zucker, der sich nur in Milch findet. Er gehört zur Gruppe der organisch- chemischen Verbindungen, die als Kohlenhydrate bezeichnet werden. Kohlenhydrate sind die wichtigste Energiequelle in unserer Nahrung. Brot und Kartoffeln sind z. B. reich an Kohlenhydraten und bilden eine Ernährungsgrundlage. Kohlenhydrate zerfallen in energiereiche Verbindungen, die an allen biochemischen Reaktionen beteiligt sein können, für die sie die nötige Energie liefern. Kohlenhydrate liefern auch Material zur Synthese einiger wichtiger chemischer Verbindungen im Körper. Sie sind in Muskeln als Muskelglykogen und in der Leber als Leberglykogen vorhanden.
Glykogen ist ein Beispiel für ein Kohlenhydrat mit hohem Molekulargewicht. Andere Beispiele sind Stärke und Zellulose. Solche zusammengesetzten Kohlenhydrate werden als Polysaccharide bezeichnet und bilden gigantische Moleküle, die aus vielen Glukosemolekülen bestehen. In Glykogen und Stärke sind die Moleküle oft verzweigt, bei Cellulose finden sich lange, gerade Ketten.
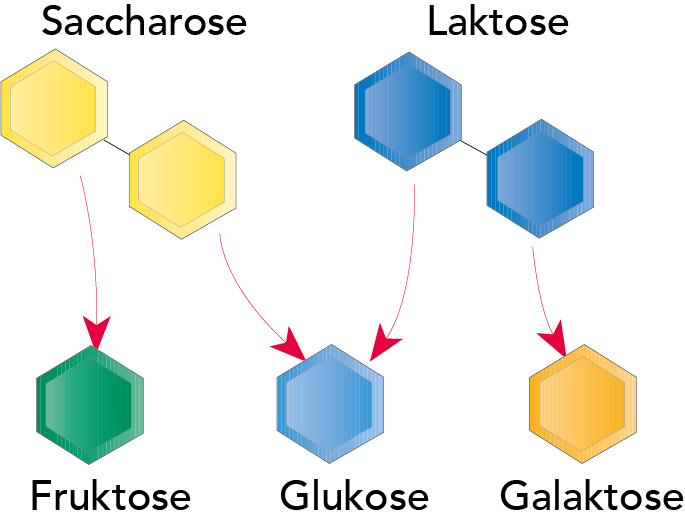
Abb. 2.41 zeigt einige Disaccharide, d. h. Kohlenhydrate, die aus zwei Arten von Zuckermolekülen aufgebaut sind. Die Moleküle der Saccharose (gewöhnlicher Rohr- oder Rübenzucker) bestehen aus den zwei Einfachzuckern (Monosaccharide) Fruktose und Glukose. Laktose (Milchzucker) ist ein Disaccharid mit einem Molekül, das sich aus den Monosacchariden Glukose und Galaktose aufbaut.
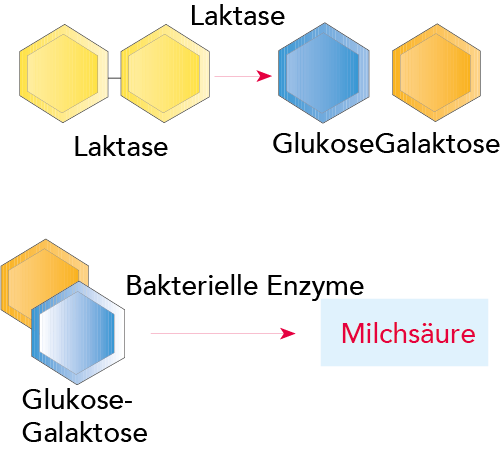
Laut Tab. 2.3 variiert der Milchzuckergehalt zwischen 3,6 und 5,5 %. Abb. 2.42 zeigt was passiert, wenn Laktose durch Milchsäurebakterien abgebaut wird. Laktose wird in die Bakterienzelle transportiert, wo Enzyme die Laktose angreifen und diese in die beiden Moleküle Glukose und Galaktose spaltet. Andere Enzyme der Milchsäurebakterien greifen dann Glukose und Galaktose an, die über komplizierte Zwischenreaktionen v. a. in Milchsäure umgesetzt werden. Die an diesen Reaktionen beteiligten Enzyme agieren in einer bestimmten Reihenfolge. Dies erfolgt beim Sauerwerden von Milch; Laktose wird zu Milchsäure fermentiert. Andere Mikroorganismen in der Milch produzieren andere Abbauprodukte.
Wird Milch auf eine hohe Temperatur erhitzt und bei dieser gehalten, wird sie braun und bekommt einen Karamelgeschmack. Dieser Prozess wird als Karamelisierung bezeichnet und bildet das Ergebnis einer chemischen Reaktion zwischen Laktose und Eiweißen, die als Maillardreaktion bezeichnet wird.
Maillardreaktionen werden nur durch Hitze induziert und halten über die gesamte Lagerdauer des Produktes an. Die Reaktionskinetik hängt direkt von den Faktoren Wärmebelastung und Lagertemperatur ab.
Laktose ist wasserlöslich und kommt in Milch in molekularer Lösung vor. Beim Käsen bleibt der größte Teil der Laktose in der Molke gelöst. Die Eindampfung von Molke bei der Herstellung von Molkenkäse erhöht die Laktosekonzentration weiter. Laktose ist nicht so süß wie andere Zucker, sie besitzt etwa 30-mal weniger Süßkraft als beispielsweise Rohrzucker.
VITAMINE IN DER MILCH
Vitamine sind organische Verbindungen, die in sehr kleinen Konzentrationen sowohl in Pflanzen als auch in Tieren vorkommen. Sie sind für die normalen Lebensprozesse essenziell und können nicht vom Körper synthetisiert werden. Der chemische Aufbau der Vitamine ist i. d. R. sehr komplex, von den meisten Vitaminen ist er heute jedoch bekannt. Vitamine werden durch Großbuchstaben gekennzeichnet, die manchmal von tief gestellten Zahlen begleitet sind, wie z.B. A, B1 und B2.
Milch bildet eine gute Vitaminquelle, die hier in verschiedenen Mengen enthalten sind. Unter den bekanntesten sind Vitamin A, die Vitamine der B-Gruppe, Vitamin C und D. Die Vitamine A und D sind fettlöslich oder Lösemittel für Fett, während die anderen wasserlöslich sind.
Unter den fettlöslichen Vitaminen sind A und D die wichtigsten. Sie wirken sich auf das Augenlicht und die Haut aus. Aus nahe liegenden Gründen enthalten fettarme Milchprodukte weniger an diesen Vitaminen. In einigen Ländern wird dieser Mangel in fettarmer Milch durch Anreicherung mit den Vitaminen A und D kompensiert, um dasselbe Vitaminniveau wie bei Vollmilch zu erreichen.
Tabelle 2.6 führt den Gehalt an Vitaminen in Konsummilch und den Tagesbedarf je Erwachsenen auf. Die Tabelle zeigt, dass Milch eine gute Vitaminquelle ist. Ein Vitaminmangel kann Mangelkrankheiten auslösen (vgl. Tab. 2.7).
MINERALSTOFFE UND SALZE IN DER MILCH
Milch enthält eine Reihe von Mineralien. Ihre Gesamtkonzentration liegt unter einem Prozent. Mineralsalze kommen als Lösung im Milchserum oder in den Kaseinverbindungen vor. Die wichtigsten Salze sind die von Kalzium, Natrium, Kalium und Magnesium. Man findet sie als Phosphate, Chloride, Zitrate und Kaseinate. Kalium- und Kalziumsalze sind die wichtigste Salzfraktion der Milch. Der Salzgehalt der Milch ist jedoch nicht konstant. Gegen Ende der Laktation und v. a. bei Euterkrankheiten steigt der Kochsalzgehalt an und gibt der Milch einen salzigen Geschmack, während die Menge anderer Salze entsprechend zurückgeht.
ANDERE BESTANDTEILE VON MILCH
Milch enthält immer somatische Zellen (weiße Blutkörperchen oder Leukozyten und abgestorbene Körperzellen). Bei Milch aus einem gesunden Euter ist ihr Anteil gering, er steigt aber an, wenn das Euter erkrankt ist; meist proportional zur Schwere der Erkrankung. Der Gehalt der Milch gesunder Kühe an somatischen Zellen beträgt i. d. R. weniger als 200.000 Zellen/ml, akzeptabel sind jedoch bis zu 400.000 Zellen/ml.
Milch enthält auch Gase, ca. 5 bis 6 Vol% in frisch gemolkener Milch. Bei Ankunft in der Molkerei kann der Gasgehalt aber bei zehn und mehr Volumenprozent liegen. Der Gasanteil setzt sich u. a. aus Kohlendioxid, Stickstoff und Sauerstoff zusammen.
Sie liegen in der Milch in drei Phasen vor:
- in der Milch gelöst,
- gebunden und nicht von Milch abseparierbar,
- in der Milch dispergiert.
Dispergierte und gelöste Gase bilden ein ernstes Problem bei der Verarbeitung von Milch, da diese anfällig für Anbrennen an wärmeübertragenden Oberflächen wird, wenn sie zu viel Gas enthält.
Veränderungen der milch und ihrer bestandteile
VERÄNDERUNGEN WÄHREND DER
LAGERUNG
Während der Lagerung können Fett und Eiweiß der Milch chemische Veränderungen erfahren. Diese Veränderungen sind meist: Oxidation und Lipolyse. Die dabei entstehenden Reaktionsprodukte können Geschmacksfehler u. a. bei Milch und Butter verursachen.
FETTOXIDATION
Die Oxidation von Fett führt zu einem metallischen Geschmack, während sie bei Butter einen ranzigen, tranigen Geschmack verursacht. Oxidation erfolgt an den Doppelbindungen der ungesättigten Fettsäuren, wobei Lecithin am anfälligsten für derartige Angriffe ist. Die Anwesenheit von Eisen- und Kupfersalzen beschleunigt das Voranschreiten der Autooxidation und die Bildung des metallischen Geschmackes ebenso wie Sauerstoff oder Bestrahlung mit Licht, speziell mit direktem Sonnenlicht oder Fluoreszenzröhren.
Einer Fettoxidation können z. T. Mikroorganismen in der Milch, eine Pasteurisierung auf über 80 °C oder antioxidative Zusätze (Reduktionsmittel) vorbeugen. Mikroorganismen wie Milchsäurebakterien verbrauchen Sauerstoff und entfalten so eine reduzierende Wirkung. Oxidationsfehlgeschmack tritt eher bei tiefen Temperaturen auf, da die Bakterien dann weniger aktiv sind. Die Löslichkeit von Sauerstoff in Milch ist zudem bei tiefen Temperaturen erhöht. Eine Hochtemperatur-Pasteurisierung hilft, da SH-Gruppen bei der Milcherhitzung als reduzierende Verbindungen gebildet werden.
Der metallische Oxidationsfehlgeschmack tritt im Winter häufiger als im Sommer auf. Dies ist z. T. auf die niedrigeren Umgebungstemperaturen und z. T. auf eine andere Kuhfütterung zurückzuführen. Sommerfutter ist reicher an den Vitaminen A und C, die die Menge an reduzierenden Substanzen in der Milch steigern.
Bei Zutritt von Licht und/oder Schwermetallionen werden die freien Fettsäuren in Schritten weiter zu Aldehyden und Ketonen abgebaut, die Fehlgeschmack wie Oxidationsranzigkeit in fettreichen Milchprodukten hervorrufen.
PROTEINOXIDATION
Dem Licht ausgesetzt, wird die Aminosäure Methionin unter komplizierter Teilnahme von Riboflavin (Vitamin B2) und Ascorbinsäure (Vitamin C) zu Methional abgebaut. Methional oder 3-Mercapto-methylpropionaldehyd ist der hauptsächliche Verursacher von Lichtgeschmack, wie dieser typische Geschmacksfehler bezeichnet wird.
Da Methionin als solches in Milch nicht vorkommt, sondern nur als Bestandteil der Milcheiweiße, muss vor der Bildung des Fehlgeschmacks ein Abbau der Proteine erfolgen.
Faktoren im Zusammenhang mit der Lichtgeschmacksentwicklung sind:
- Intensität des Lichts (Sonnenlicht und/oder künstliches Licht, u. a. von Fluoreszenzröhren)
- Einwirkungsdauer
- bestimmte Milcheigenschaften - homogenisierte Milch hat sich als empfindlicher erwiesen als nicht homogenisierte Milch
- Art der Packung – undurchsichtige Packungen wie Kunststoff und Karton bieten unter normalen Umständen einen guten Schutz.
Siehe dazu auch Kapitel 8, das sich mit der Qualitätserhaltung pasteurisierter Milch befasst.
LIPOLYSE
Der Abbau von Fett zu Glyzerin und freien Fettsäuren wird als Lipolyse bezeichnet. Lipolysiertes Fett hat einen ranzigen Geschmack und Geruch, der durch niedrigmolekulare freie Fettsäuren (Buttersäure und Capronsäure) verursacht wird.
Lipolyse wird durch die Aktivität von Lipasen verursacht und durch hohe Lagertemperaturen begünstigt. Eine Lipolyse kann jedoch nicht erfolgen, bevor nicht die Fettkügelchen beschädigt sind, sodass das Fett exponiert ist (vgl. Abb. 2.43). Nur dann kann die Lipase angreifen und die Fettmoleküle hydrolysieren. Bei herkömmlichen Molkereiprozessen bestehen viele Gelegenheiten zur Beschädigung der Fettkügelchen, z. B. durch Pumpen, Rühren oder Spritzen. Ein übermäßiges Rühren von unpasteurisierter Milch sollte daher vermieden werden, da dies das Risiko eines groß angelegten Lipaseangriffs mit Freisetzung freier Fettsäuren birgt, die die Milch ranzig werden lassen. Um Lipasen vom Fettabbau abzuhalten, müssen sie durch Hochtemperaturpasteurisierung inaktiviert werden. Dies zerstört das originäre Enzym vollständig. Bakterielle Enzyme sind widerstandsfähiger. Nicht einmal eine UHT-Behandlung kann sie ganz zerstören. (UHT = Ultra High Temperature, d. h. Erhitzung auf 135 bis 150 °C oder höher für einige Sekunden).
AUSWIRKUNGEN EINER WÄRMEBEHANDLUNG
Milch wird in der Molkerei wärmebehandelt, um alle möglicherweise anwesenden pathogenen Mikroorganismen abzutöten. Die Wärmebehandlung verursacht aber auch Veränderungen bei den Milchbestandteilen. Je höher die Temperatur und je länger die Einwirkung der Hitze, desto umfangreicher werden diese Veränderungen. In bestimmten Grenzen können Zeit und Temperatur gegeneinander balanciert werden. Eine kurze Erhitzung auf eine hohe Temperatur kann denselben Effekt zeigen wie eine längere Erhitzung bei einer niedrigeren Temperatur. Bei der Wärmebehandlung sind also stets Zeit und Temperatur zu betrachten.
FETt
Von den Hauptbestandteilen der Milch ist Fett vermutlich der am wenigsten von der Erhitzung beeinflusste. Hitzebedingte Veränderungen, insbesondere hinsichtlich der physikalischen Eigenschaften, treten jedoch im Milchfett auf. Die Hauptwirkung einer Wärmebehandlung auf Milchfett besteht in der Aufrahmung der Fettkügelchen. Das Auftreten einer Rahmpfropfenbildung zeigte sich bei der Pasteurisation von Milch auf 70 bis 80°C für 15 Sekunden (Thomé & al, Milchwissenschaft 13, 115, 1958) (vgl. Abb. 2.44.). Es wurden hierfür verschiedene Theorien diskutiert, aber es scheint, dass freigesetztes Fett die Fettkügelchen beim Kollidieren miteinander verklebt. Um eine Aufrahmung von Milch zu vermeiden, ist die Homogensierung zu empfehlen.
A. Fink und H.G. Kessler (Milchwissenschaft 40. 6-7, 1985) zeigten, dass aus den Fettkügelchen 30%igen Rahms (homogenisiert und nicht homogenisiert) freies Fett austritt, wenn dieser auf Temperaturen zwischen 105 und 135 °C erhitzt wird. Dies wird vermutlich durch eine Destabilisierung der Fettkügelchenmembranen hervorgerufen, was zu höherer Durchlässigkeit führt. Als Folge davon wirkt das extrahierbare Fett wie ein Kleber zwischen kollidierenden Fettkügelchen und produziert so stabile Cluster.
Über 135 °C bilden die Proteine auf der Fettkügelchenmembran ein Netzwerk, das die Membran dichter und weniger durchlässig macht. Eine Homogenisierung nach dem Erhitzen wird daher zur UHT-Behandlung fettreicher Produkte empfohlen.
PROTEIN
Das Hauptprotein der Milch, Kasein, gilt in normalen pH-Bereichen und normalem Salz- und Eiweißgehalt als nicht denaturierbar.
Molkenproteine, speziell b-Laktoglobulin, das ca. 50 % des Molkenproteinanteils ausmacht, sind dagegen recht hitzeempfindlich. Die Denaturierung setzt bei 65 °C ein und bei Erhitzung auf 95 °C für 5 Minuten ist sie nahezu vollständig erfolgt.
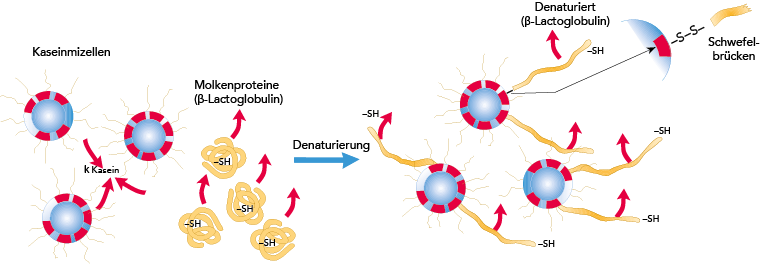
Die Denaturierung von Molkenproteinen ist eine irreversible Reaktion. Die zufallsartig gefalteten Proteine „öffnen sich", speziell b-Laktoglobulin bindet sich u. a. über Schwefelbrücken an die hervorstehende k-Kaseinkette. Ein stark vereinfachtes Bild der Vorgänge findet sich in Abb. 2.45.
Die Blockade eines großen Teils des k-Kaseins stört die Labfähigkeit der Milch, da das beim Käsen benutzte Lab in seiner Fähigkeit gehindert wird, das k-Kasein von den Kaseinmizellen abzuspalten. Je höher die Pasteurisierungstemperatur bei konstanter Heißhaltezeit ist, desto weicher wird das Koagulum. Dies ist bei der Produktion von Schnitt- und Hartkäsen jedoch unerwünscht. Da jedoch die Möglichkeit besteht, dass bei aus Rohmilch hergestelltem Käse krankheitserregende Bakterien (insbesondere Listeria monocytogenes) überleben und sich vermehren, wird aus Sicherheitsgründen empfohlen, die für die Käseherstellung bestimmte Milch 15 bis 20 Sekunden lang bei einer Temperatur von 72 °C zu pasteurisieren. Käse kann zwar auch aus Rohmilch hergestellt werden, fällt dann jedoch unter strenge Kontrollen durch nationale Gesetze.
Bei Milch, die zu fermentierten Milchprodukten verarbeitet werden soll (Joghurt usw.), tragen die bei 90 bis 95 °C für 3 bis 5 Minuten erhaltene Denaturierung und die folgende Wechselwirkung des Molkenproteins mit dem Kasein zu einer verbesserten Produktqualität durch reduzierte Molkenlässigkeit und höhere Viskosität bei.
Milch, die für 20 bis 60 Sekunden auf 75 °C erhitzt wird, beginnt einen Kochgeschmack zu entwickeln. Dies ist auf die Freisetzung von Schwefelverbindungen aus dem b-Lactoglobulin und anderen schwefelhaltigen Eiweißen, den inaktiven Lipoproteinen, zurückzuführen.
ENZYME
Enzyme können durch Erhitzen inaktiviert werden. Die Inaktivierungstemperatur variiert je nach Art des Enzyms.
Das Bakterium Pseudomonas spp (spp = species) wird heute sehr oft als Teil der Verderbsflora in kalt gelagerter Rohmilch und erhitzten Milchprodukten zitiert, da es extreme hitzestabile proteolytische und lipolytische Enzyme produziert. Pasteurisation oder UHT-Behandlung inaktivieren sie nur zu einem kleinen Teil.
LAKTOSE
Laktose erfährt in Milch eher Veränderungen als in getrockneter Form. Bei Temperaturen über 100 °C kommt es zu einer Reaktion zwischen Laktose und Protein, die zu einer bräunlichen Verfärbung führt. Die Reaktionsabfolge zwischen Aminogruppen von Aminosäuren und Aldehydgruppen bei den Kohlenhydraten der Milch wird als Maillard- oder Bräunungsreaktion bezeichnet. Sie führt sowohl zu einer Bräunung und Geschmacksveränderung des Produkts als auch zu einem Verlust an ernährungsphysiologischem Wert, u. a. durch den Abbau der essentiellen Aminosäure Lysin.
Laktulose ist ein Epimer der Laktose, das sich in erhitzter Milch findet (Adachi, 1958). Da der Laktulosegehalt mit steigender Hitzebelastung ansteigt, kann er dazu verwendet werden, zwischen pasteurisierter, UHT- und sterilisierter Milch zu unterscheiden (Martinez Castro & Olano, 1982, und Geier & Klostermeyer, 1983).
VitaminE
Milch bildet eine wichtige Quelle für Vitamin A, D und die der B-Gruppe. Die fettlöslichen Vitamine sind sehr hitzestabil, ihr Gehalt wird durch Erhitzen nicht verringert. Wird Milch aber mit Vitamin A angereichert, scheint der relative Verlust zu steigen.
Vitaminverluste betreffen u. a. Vitamin C und einige Vitamine der B-Gruppe. Der Verlust an Vitamin C ist generell von untergeordneter Bedeutung, da Milch an sich keine große Quelle für dieses Vitamin darstellt; der Verlust kann sich aber auf den Ernährungswert insgesamt auswirken. Der Abbau von Vitamin C ist mit dem von Vitamin B12 verbunden und schützt die Folsäure vor Oxidation. Vitaminabbau bezieht sich nicht nur auf die Erhitzung, sondern auch auf die Lagerung des Endproduktes. Ein Vitaminverlust während der Lagerung kann zum großen Teil vermieden werden, wenn Sauerstoff und Licht am Zutritt gehindert werden. Vitamin C und B9 können binnen einiger Tage völlig verschwinden, wenn der Sauerstoffgehalt im Produkt hoch ist. Die Reaktion wird durch Riboflavin (Vitamin B2) katalysiert und durch Lichtbestrahlung beschleunigt. Der größte Teil des Riboflavins verschwindet nach längerer Lichteinstrahlung.
Verluste von einigen Vitaminen abhängig von verschiedenen Bearbeitungs- verfahren sind in Tabelle 2.8 zusammengestellt.
MINERALSTOFFE
Die Löslichkeit von Kalziumphosphat ist stark temperaturabhängig. Ungleich vielen anderen Verbindungen, nimmt die Löslichkeit von Ca-Phosphat mit der Temperatur ab. Das heißt, die Erhitzung verursacht eine Ausfällung von Ca-Phosphat als KCP in der Mizelle, während Kühlen die Konzentration löslichen Ca-Phosphats erhöht. Nach dem Abkühlen ist diese Reaktion leicht reversibel. Nach dem Erhitzen auf hohe Temperaturen ist die Reversibilität unvollständig und langsam.
Die Veränderungen bei hohen Temperaturen implizieren, dass Milch sauer wird und der pH-Wert sinkt, wie in der unten stehenden Tabelle 2.9. angegeben.
Die Veränderungen des pH-Werts können wie folgt erklärt werden:
Physikalische eigenschaften der milch
ERSCHEINUNGSBILD
Das Aussehen und die Trübheit der Milch wird auf ihren Gehalt an suspendierten Teilchen an Fett, Eiweißen und bestimmten Mineralstoffen zurückgeführt. Die Farbe variiert von weiß zu gelb, je nach der Färbung des Fettes (Karotingehalt). Magermilch ist transparenter, mit einem leicht bläulichen Stich.
DICHTE
Die Dichte von Kuhmilch schwankt abhängig von der Zusammensetzung i. d. R. zwischen 1,028 und 1,038 g/cm3. Die Dichte von Milch bei 15,5 °C kann nach folgender Formel berechnet werden:
Nachstehend finden Sie ein Beispiel:
OSMOTISCHER DRUCK
Der osmotische Druck wird von der Anzahl der Moleküle und Teilchen, nicht aber vom Gewicht der Lösung bestimmt. 100 Moleküle der Größe 10 bringen daher den zehnfachen osmotischen Druck wie 10 Moleküle der Größe 100.
Daraus folgt, dass bei gegebenem Gewicht der osmotische Druck umso höher ist, je kleiner die Moleküle sind.
Milch wird aus dem Blut gebildet, wobei beide durch eine permeable Membran getrennt sind, so dass sie den gleichen osmotischen Druck haben. Mit anderen Worten, Milch und Blut sind isotonisch. Der osmotische Druck von Blut ist bemerkenswert konstant, obwohl sich dessen Zusammensetzung bzgl. Pigmenten, Eiweiß usw. ändern kann. Dasselbe gilt für Milch. Die den osmotischen Druck bildenden Inhaltsstoffe sind in Tabelle 2.10 aufgeführt.
GEFRIERPUNKT
Der Gefrierpunkt der Milch liefert den einzigen verlässlichen Parameter, um eine Prüfung auf Verwässerung vornehmen zu können. Der Gefrierpunkt der Milch verschiedener Kühe variiert von -0,51 bis -0,55 °C.
In diesem Zusammenhang sollte angemerkt werden, dass in mit hoher Temperatur behandelter Milch(UHT-oder Sterilmilch) die Ausfällung eines Teils der Phosphate den Gefrierpunkt ansteigen lässt.
Der innere oder osmotische Druck bestimmt auch den Gefrierpunktsunterschied zwischen Lösung und Lösungsmittel (Wasser), sodass die Absenkung des Gefrierpunktes (Gefrierpunktsdepression D in Tab. 2.10) ein Maß für den osmotischen Druck bildet. Ändert sich die Milchzusammensetzung aus physiologischen oder pathologischen Gründen (z. B. späte Laktationsphase oder Mastitis), wird sie als anormal bezeichnet, auch wenn der osmotische Druck und somit der Gefrierpunkt konstant bleiben. Die häufigste Veränderung besteht in einem Sinken des Laktose- und einem Anstieg des Chloridgehaltes.
ACIDITÄT
Die Acidität (der Säuregrad) einer Lösung hängt von der Konzentration ihrer Hydroniumionen [H+] ab. Sind die Konzentrationen von [H+] und [OH-] (Hydroxyl-) Ionen gleich, wird die Lösung als neutral bezeichnet. In einer neutralen Lösung beträgt die Anzahl der [H+]Ionen pro Liter Lösung 1:10.000.000 mol oder 10-7.
Der pH-Wert steht für die Hydroniumionenkonzentration einer Lösung und kann mathematisch als negativer (dekadischer) Logarithmus der Hydroniumionenkonzentration [H+] definiert werden.
Auf das obige Beispiel angewendet, beträgt der pH-Wert pH = - log 10-7 = 7, was typisch für eine neutrale Lösung ist. Ist [H+] 1 :100 000 mol/l oder 10-6, beträgt der pH-Wert 6 und die Lösung ist sauer. Je niedriger der Exponent, desto höher ist die Acidität.
Der pH-Wert einer Lösung oder eines Produkts stellt die (echte) präsente Acidität dar. Normale Milch ist eine leicht saure Lösung mit einem pH-Wert zwischen 6,6 und 6,8 mit 6,7 als dem häufigsten Wert bei einer Messtemperatur von etwa 25 °C. Der pH-Wert wird mit einem pH-Meter gemessen.
TITRIERBARE ACIDITÄT
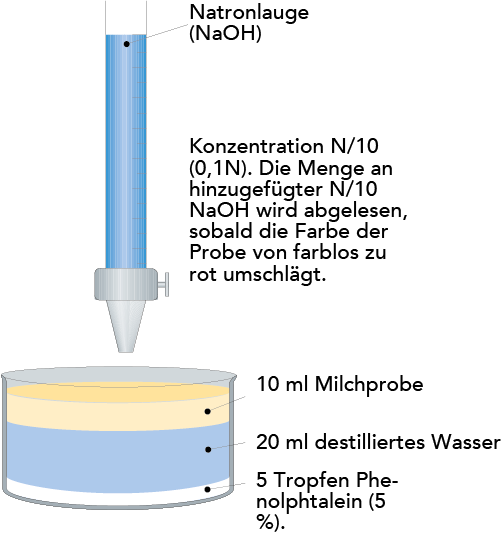
Acidität kann auch als titrierbare Acidität angegeben werden. Die titrierbare Acidität von Milch ist ein Maß für die Menge an einer Hydroxydionenlösung (OH–) einer bestimmten Stärke, die nötig ist, um den pH-Wert einer gegebenen Menge Milch auf ca. pH 8,4 zu bringen, bei dem der normalerweise benutzte Indikator Phenolphtalein die Farbe von farblos nach rosa wechselt. Der Test gibt an, wie viel Lauge nötig ist, um den pH-Wert von 6,7 auf 8,4 zu bringen.
Säuert Milch infolge bakterieller Aktivität, wird eine größere Menge an Lauge benötigt, sodass die Acidität oder der Titrationswert der Milch steigen.
Die titrierbare Acidität kann in verschiedenen Werten angegeben werden, wobei die Stärke der für die Titration nötigen Natronlauge (NaOH) die Basis bildet.
- °SH = Grad Soxhlet Henkel, erhalten durch Titration von 100 ml Milch mit N/4 NaOH und Phenolphtalein als Indikator. Normale Milch liefert Werte von ca. 7. Diese Methode wird häufig in Zentraleuropa verwendet.
- °Th = Grad Thörner, erhalten durch Titration von 100 ml Milch, verdünnt mit 200 ml destilliertem Wasser, mit N/10 NaOH und Phenolphtalein als Indikator. Normale Milch liefert Werte von ca. 17. Am häufigsten in Schweden verwendet.
- °D = Grad Dornic, erhalten durch Titration von 100 ml Milch mit N/9 NaOH und Phenolphtalein als Indikator. Normale Milch liefert Werte von ca. 15. Meist in den Niederlanden und Frankreich verwendet.
- % l.a. = Prozent Lactic Acid (Milchsäure), ermittelt als °D, mit dem Ergebnis geteilt durch 100. Häufig im Vereinigten Königreich, in den USA, Kanada, Australien und Neuseeland verwendet.
Tabelle 2.11 führt die verschiedenen Ausdrücke für die titrierbare Acidität auf. Die Bestimmung der Acidität nach der Methode Thörner ist in Abb. 2.46 dargestellt.
1,7 ml N/10 NaOH werden für die Titration einer 10-ml-Probe Milch benötigt. 10 x 1,7 = 17 ml wären also für 100 ml erforderlich. Die Acidität von Milch beträgt folglich 17 °Th.
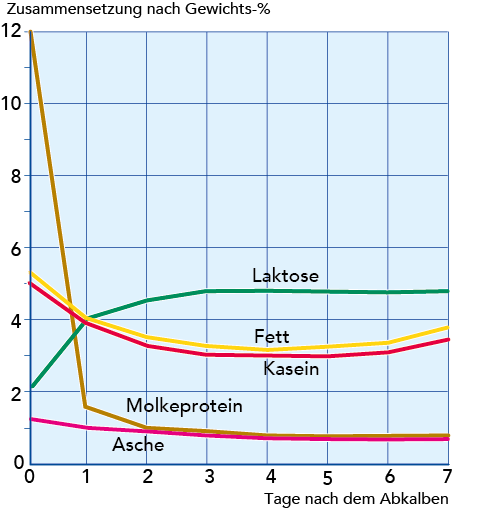
Kolostrum
Die erste Milch nach dem Abkalben wird als Kolostrum bezeichnet. Sie unterscheidet sich in Zusammensetzung und Eigenschaften stark von der normalen Milch. Ein besonders hervorstechendes Merkmal ist der hohe Gehalt an Molkenproteinen – ca. 11 % verglichen mit ca. 0,65 % in herkömmlicher Milch (vgl. Abb. 2.47). Deswegen koaguliert Kolostrum auch beim Erhitzen. Einen relativ großen Teil der Molkenproteine bilden Immunoglobuline (Ig G dominiert im Kolostrum), die das Kalb vor Infektionen schützen, bis sein eigenes Immunsystem aufgebaut ist. Kolostrum hat eine bräunlich-gelbe Farbe, einen eigentümlichen Geruch und einen ziemlich salzigen Geschmack. Der Gehalt an Katalase und Peroxidase ist hoch. Vier bis fünf Tage nach dem Kalben beginnt die Kuh mit der Produktion von Milch normaler Zusammensetzung, die mit anderer Milch vermengt werden kann.