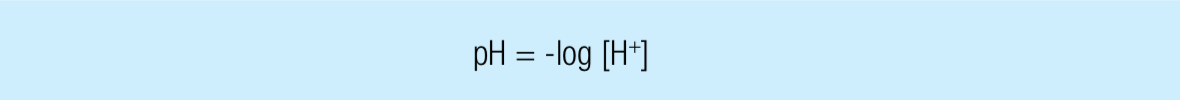БИОХИМИЯ МОЛОКА
Основными компонентами молока являются вода, жир, белки, лактоза (молочный сахар) и минеральные вещества (соли). Молоко содержит также незначительные количества таких веществ, как пигменты, ферменты, фосфолипиды (вещества с жироподобными свойствами) и газы.
Остаток после удаления из молока воды и газов называется сухим веществом (СВ) или
общим содержанием растворенных и нерастворенных веществ молока. Молоко является очень сложным продуктом. Для описания различных компонентов молока и того, как на них воздействуют различные стадии переработки молока, необходимо обратиться к химической терминологии. Поэтому эта глава, посвященная химии молока, начинается с кратких сведений о некоторых основных химических понятиях.
Химические символы некоторых общеизвестных элементов, присутствующих в органическом веществе:
C Углерод
Cl Хлор
H Водород
I Йод
K Калий
N Азот
Na Натрий
O Кислород
P Фосфор
S Сера
Основные химические понятия
Атомы
Атом является наименьшим строительным блоком всех веществ в природе и не может быть разделен химическим путем. Совокупность атомов с одинаковым зарядом ядра называется химическим элементом. В настоящее время известно более 100 элементов. Их примерами являются кислород, углерод, медь, водород и железо. Однако большинство встречающихся в природе веществ состоит из нескольких различных элементов. Воздух, например, является смесью кислорода, азота, двуокиси углерода и инертных газов, а вода является химическим соединением элементов – водорода и кислорода.
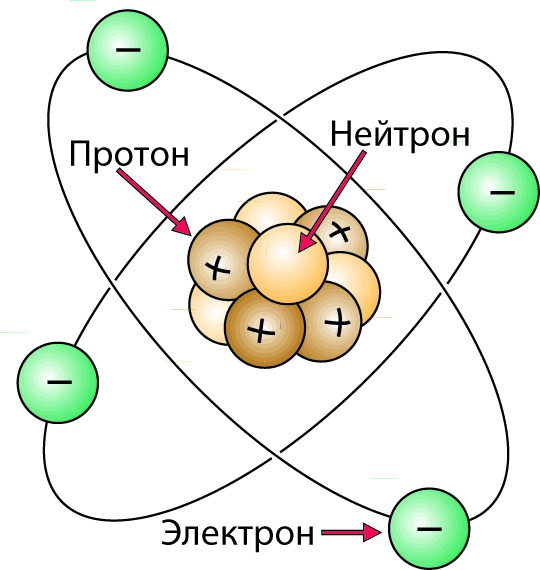
Ядро атома состоит из протонов и нейтронов, рис. 2.1. Протоны несут положительный заряд, в то время как нейтроны электрически нейтральны. Электроны, которые вращаются поорбитам вокруг ядра, несут отрицательный заряд, равный по величине и противоположный по знаку заряду протонов. Атом содержит равное число протонов и электронов с равным числом положительных и отрицательных зарядов. Поэтому атом электрически нейтрален. Атом очень мал, рис. 2.2. В маленькой медной монете имеется столько же атомов, сколько секунд в тысяче миллионов миллионов лет! Даже при этом атом состоит главным образом из пустого пространства. Если мы примем диаметр ядра за единицу, то диаметр всего атома составит около десяти тысяч.
Ионы
Атом может потерять или получить один или несколько электронов. Такой атом больше не является электрически нейтральным – он называется ионом. Если ион содержит больше электронов, чем протонов, он будет отрицательно заряженным, а если он потерял один или больше электронов, то он будет заряжен положительно.
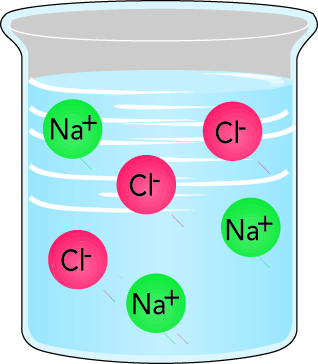
Положительно и отрицательно заряженные ионы всегда присутствуют одновременно, например в растворах в виде катионов (положительный заряд) и анионов (отрицательный заряд) или в твердом состоянии в виде солей. Обычная соль состоит из ионов натрия (Na) и хлора (CI) и имеет формулу NaCI (хлорид натрия).
Молекулы
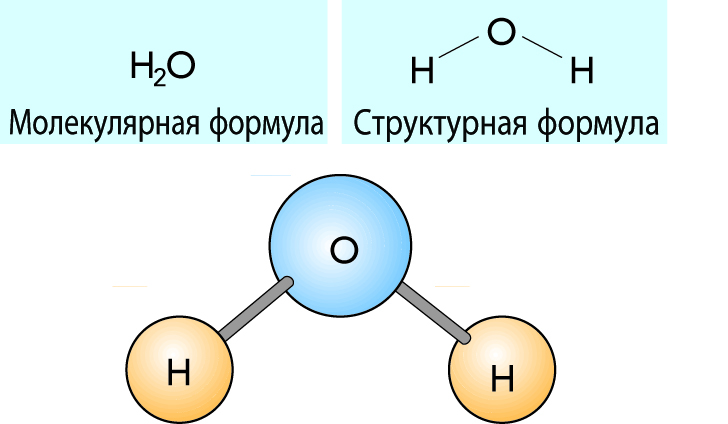
Атомы одного и того же элемента или разных элементов могут объединяться в более крупные соединения, называемые молекулами. Молекулы могут затем образовывать твердые вещества, например железо (Fe) или песок (SiO2); жидкости, например воду (H2O); или газы, например водород (H2). Если молекула состоит в основном из атомов углерода (С), водорода (H) и кислорода (O), то полученное соединение называют органическим, то есть полученным из органических элементов. Примером такого соединения является молочная кислота (C3H6O3). Эта формула означает, что ее молекула образована тремя атомами углерода, шестью атомами водорода и тремя атомами кислорода.
Число атомов в молекуле может варьироваться в очень широких пределах. Существуют молекулы, состоящие из двух связанных атомов, а другие состоят из сотен атомов.
Основные физико- химические свойства коровьего молока
Коровье молоко состоит примерно на 87 % из воды и на 13 % из сухих веществ, таблица 2.1. Данные сухие вещества находятся во взвешенном состоянии или растворены в воде. В зависимости от типа сухого вещества и размера частиц (таблица 2.2) существуют различные системы распределения их в водной фазе.
Органические соединения в основном содержат углерод, кислород и водород. Неорганические соединения в основном содержат атомы других химических элементов.
Определения
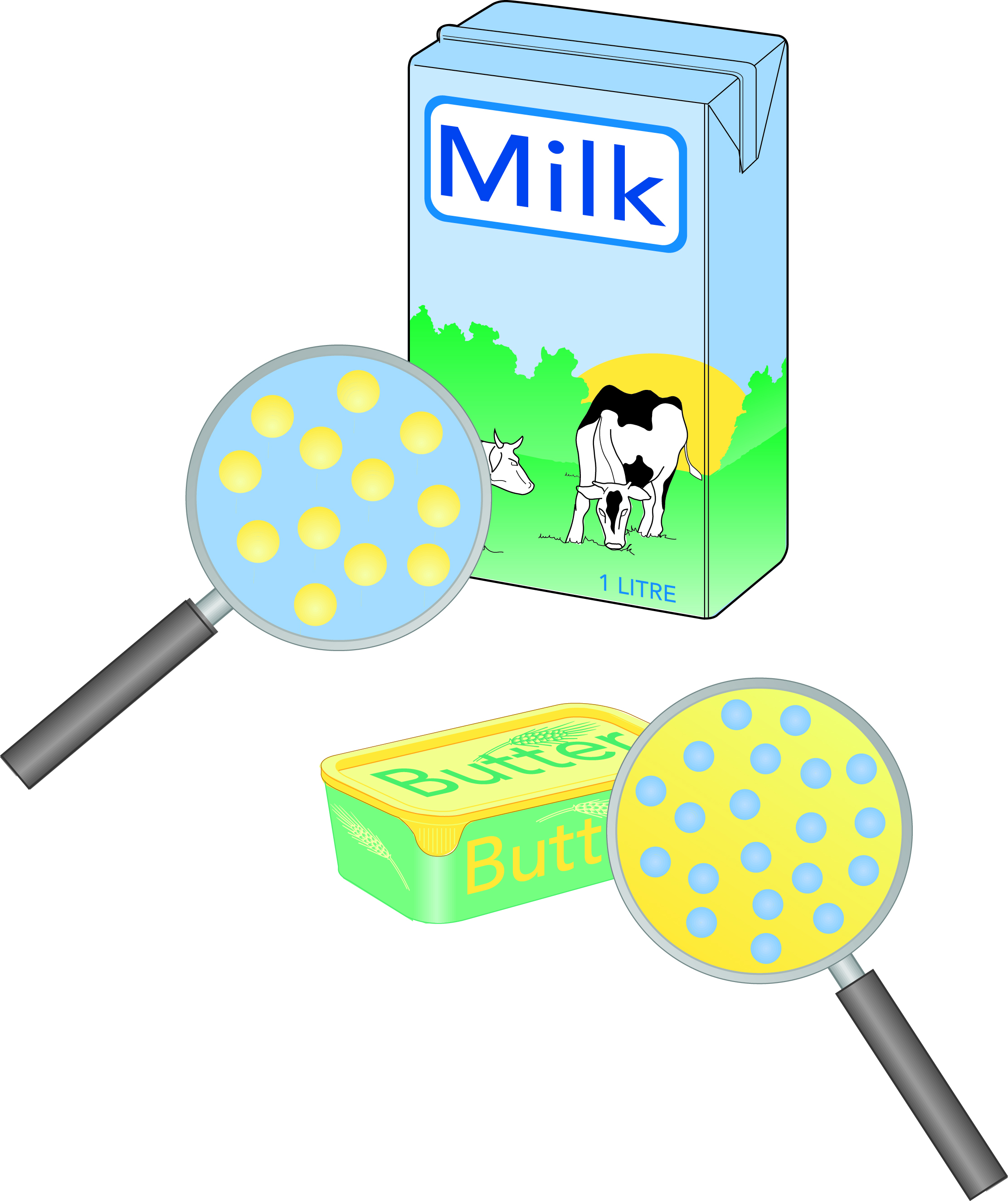
Эмульсия: дисперсная система, в которой мелкораздробленные капли одной жидкости находятся в другой. Молоко является эмульсией жира в воде (ж/в), масло – эмульсией воды в жире (в/ж), рис. 2.5. Мелкодисперсную жидкость называют дисперсной фазой, а другую жидкость – диспергированной фазой.
Коллоидный раствор: когда вещество имеет степень дисперсии, промежуточную между истинным раствором (например, сахар в воде) и суспензией (например, мел в воде), то говорят, что оно находится в коллоидном растворе или в коллоидной суспензии.
Типичными характеристиками коллоида являются:
- маленький размер частиц;
- электрический заряд; и
- притяжение частиц к молекулам воды.
Сывороточные белки представлены в молоке в виде коллоидного раствора, а казеины сравнительно большего размера – коллоидной суспензией (см. рис. 2.6).
Такие вещества, как соли, дестабилизируют коллоидные системы, изменяя связывающую способность воды и тем самым снижая растворимость белков. Такие факторы, как нагревание, вызывают развертывание сывороточных белков и повышенное взаимодействие между белками, а спирт может вызывать обезвоживание частиц.
Истинные растворы: вещества, которые при смешивании с водой и другими жидкостями образуют истинные растворы, делятся на:
- Неионогенные растворы. Когда лактоза растворяется в воде в ее молекулярной структуре не происходит существенных изменений.
- Ионогенные растворы. Когда обычная соль растворяется в воде, в воде появляются катионы (Na+) и анионы (Cl-), образующие электролит, рис. 2.7.
Кислотность растворов
Когда кислота (например, соляная (HCI)) смешивается с водой, она выделяет ионы водорода (протоны) с положительными зарядами (Н+). Они быстро присоединяются к молекулам воды с образованием ионов гидроксония (H3O+).
Когда основание (оксид или гидроксид металла) добавляют в воду, оно образует основной или щелочной раствор. При растворении основания выделяются гидроксидные (ОН-) ионы.
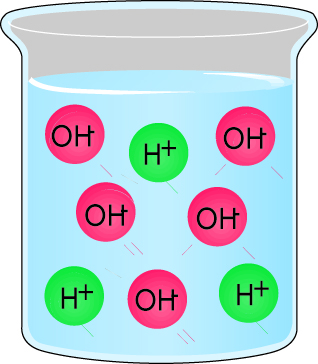
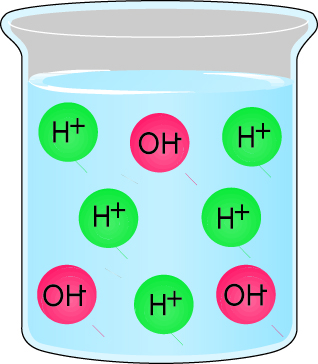
- Раствор, который содержит равное число гидроксидных ионов и водородных ионов, является нейтральным. Рис. 2.8.
- Раствор, который содержит больше гидроксидных ионов, чем водородных ионов, является щелочью. Рис. 2.9.
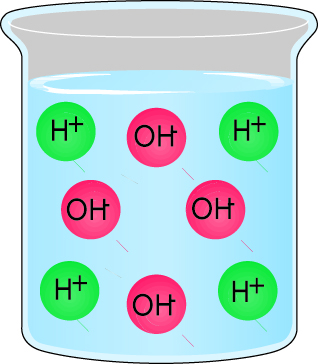
- Раствор, который содержит больше водородных ионов, чем гидроксидных ионов, является кислотой. Рис. 2.10.
Ph
Кислотность раствора определяют концентрацией ионов водорода. Однако эта концентрация очень сильно меняется от раствора к раствору. Для обозначения концентрации ионов водорода используют показатель рН.
Математически он представляет собой отрицательный десятичный логарифм молярной концентрации водородных ионов, то есть рН = -log [H+]. На этой основе построена следующая градация при 25 °С:
pH > 7 – щелочной раствор
pH = 7 – нейтральный раствор
pH < 7 – кислотный раствор
Нейтрализация
При смешивании кислоты со щелочью гидроксидные ионы реагируют с водородными ионами с образованием воды. Если смешать кислоту и щелочь в определенной пропорции, можно получить нейтральную смесь без избытка ионов водорода или гидроксидных ионов, которая имеет рН 7. Этот процесс называется нейтрализацией, а химическая формула:
В результате нейтрализации образуется соль. Когда соляную кислоту (HCI) смешивают с гидроксидом натрия, они реагируют, образуя хлорид натрия (NaCI) и воду (H2O). Соли соляной кислоты называются хлоридами, а другие соли называются подобным же образом по имени тех кислот, из которых они образованы: лимонная кислота образует цитраты, азотная – нитраты и так далее.
Диффузия
На частички, присутствующие в растворах, – ионы, молекулы или коллоидные частицы – действуют силы, заставляющие их мигрировать (диффундировать) из областей с высокой концентрацией в зоны с низкой концентрацией. Процесс диффузии протекает до тех пор, пока весь раствор не станет однородным с одинаковой концентрацией по всему объему.
Растворение сахара в чашке кофе является примером диффузии. Сахар быстро растворяется в горячем напитке, и молекулы сахара диффундируют до тех пор, пока их распределение по напитку не станет однородным.
Скорость диффузии определяется скоростью перемещения частиц, которая в свою очередь зависит от температуры, размера частиц и разности в концентрации в разных частях раствора.
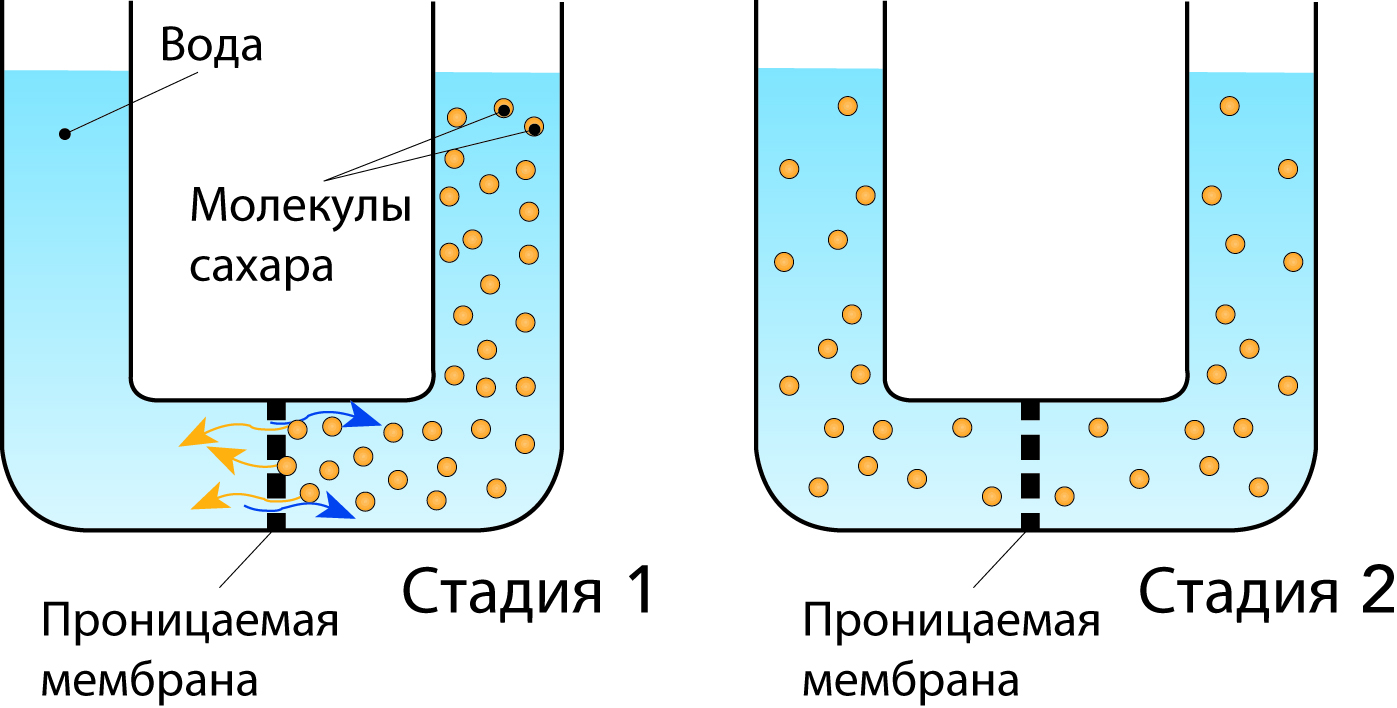
Рис. 2.11 иллюстрирует принцип процесса диффузии.
U-образная трубка разделена на 2 отделения проницаемой мембраной. Левую часть затем заполняют водой, а правую – раствором сахара, молекулы которого могут проходить через мембрану. Через некоторое время благодаря диффузии концентрация становится одинаковой по обе стороны мембраны.
Осмос
Термин «осмос» используется для описания спонтанного течения чистой воды в водный раствор или из менее концентрированного раствора в раствор с большей концентрацией при разделении этих растворов подходящей мембраной. Явление осмоса может быть проиллюстрировано примером, приведенным на рис. 2.12. U-образная трубка разделена на 2 отделения полупроницаемой мембраной. Левую часть затем заполняют водой, а правую – раствором сахара, молекулы которого не могут проходить через мембрану. Теперь молекулы воды будут диффундировать через мембрану в раствор сахара и разбавлять его до более низкой концентрации. Этот процесс и называют осмосом.
Объем раствора сахара при разбавлении растет. Уровень раствора повышается, как это видно на рис. 2.12, а гидростатическое давление «а» раствора на мембрану становится больше, чем давление воды с другой ее стороны. В этом неравновесном состоянии молекулы воды под влиянием более высокого гидростатического давления в растворе начинают диффундировать обратно в противоположном направлении.
Когда диффузия воды в обоих направлениях становится одинаковой, система приходит в состояние равновесия. Если же к раствору сахара изначально приложить гидростатическое давление, то прием воды через мембрану может быть сокращен. Гидростатическое давление, необходимое для предотвращения выравнивания концентрации за счет диффузии воды в раствор сахара, называют осмотическим давлением этого раствора.
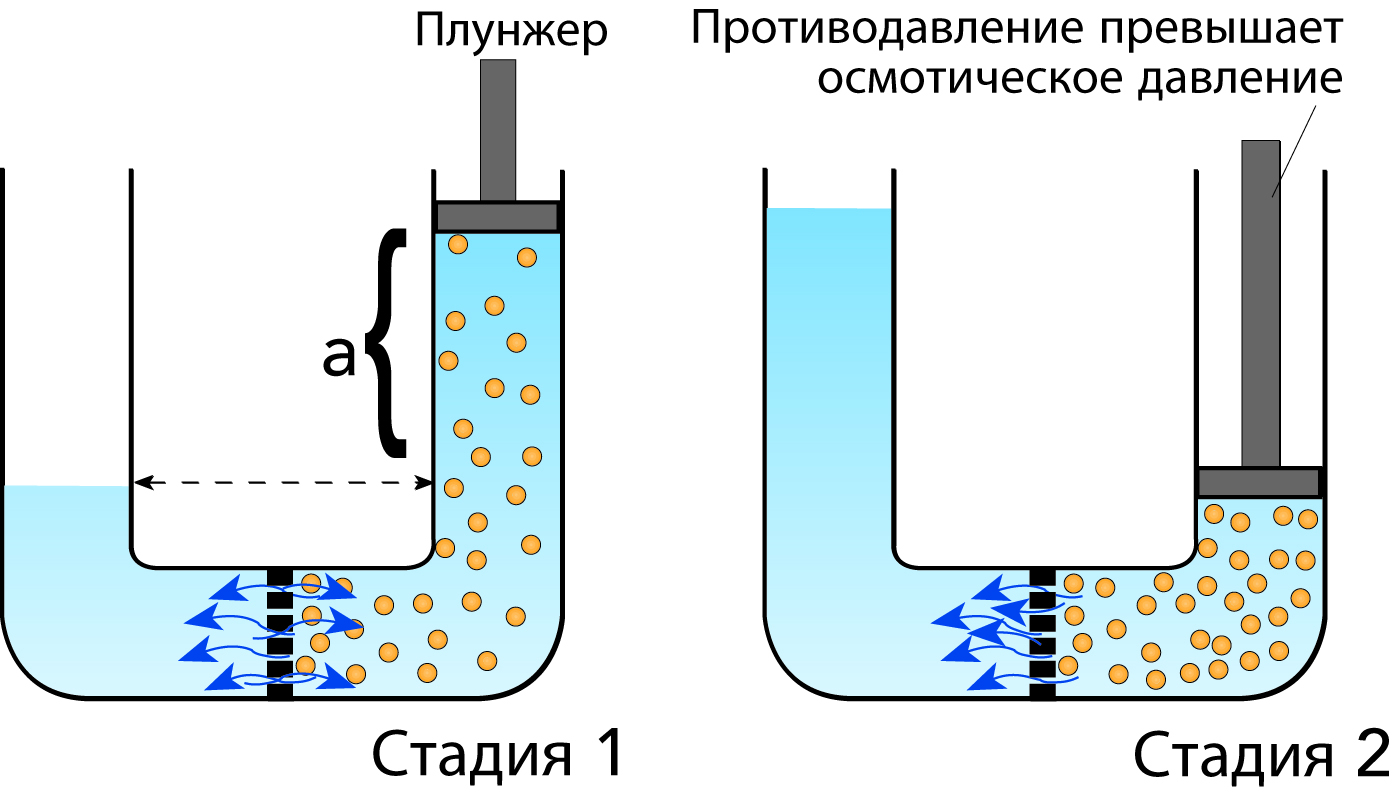
Обратный осмос
Если к раствору сахара приложить давление, превышающее осмотическое давление, то молекулы воды смогут диффундировать из раствора в воду, вызывая повышение концентрации раствора. Этот процесс, проиллюстрированный на рис. 2.13, применяется в промышленности для повышения концентрации растворов и называется обратным осмосом (ОО).
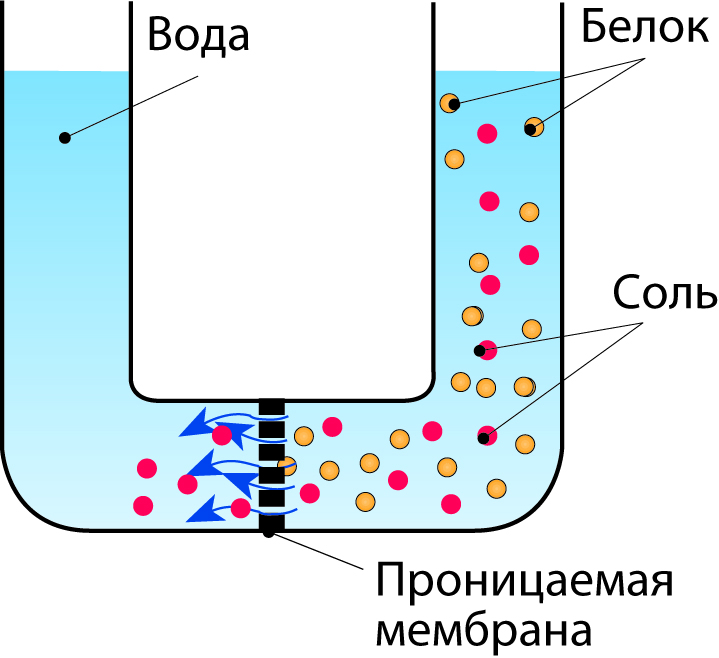
Диализ
Диализ – это процесс применения разности концентраций в качестве движущей силы для разделения в растворе крупных и небольших частиц, например белков и солей. Обрабатываемый раствор помещают по одну сторону мембраны, а растворитель (воду) – по другую. Мембрана имеет поры с диаметром, допускающим прохождение через нее небольших молекул соли, но слишком маленьким для прохождения крупных молекул белка, см. рис. 2.14. Скорость диффузии зависит от разности концентраций, так что диализ можно ускорить частой заменой растворителя по другую сторону мембраны.
Состав коровьего молока
Содержание различных основных компонентов молока может сильно различаться у коров как разных пород, так и одной и той же породы. Поэтому возможно указать лишь пределы, в которых находятся эти отличия. Цифры в таблице 2.3 приведены только в качестве примера.
При описании состава молока, помимо общего сухого остатка, применяют и термин «сухой обезжиренный молочный остаток» (СОМО). СОМО – это величина общего сухого остатка за вычетом содержания жира. Средняя величина СОМО согласно таблице 2.3 составляет 12,8 - 3,9 = 8,9 %. У обычного молока величина рН находится между 6,65 и 6,80 со средним значением 6,7, которое встречается особо часто. Это значение соответствует рН молока, измеренному при температуре около 25 °С.
Молочный жир
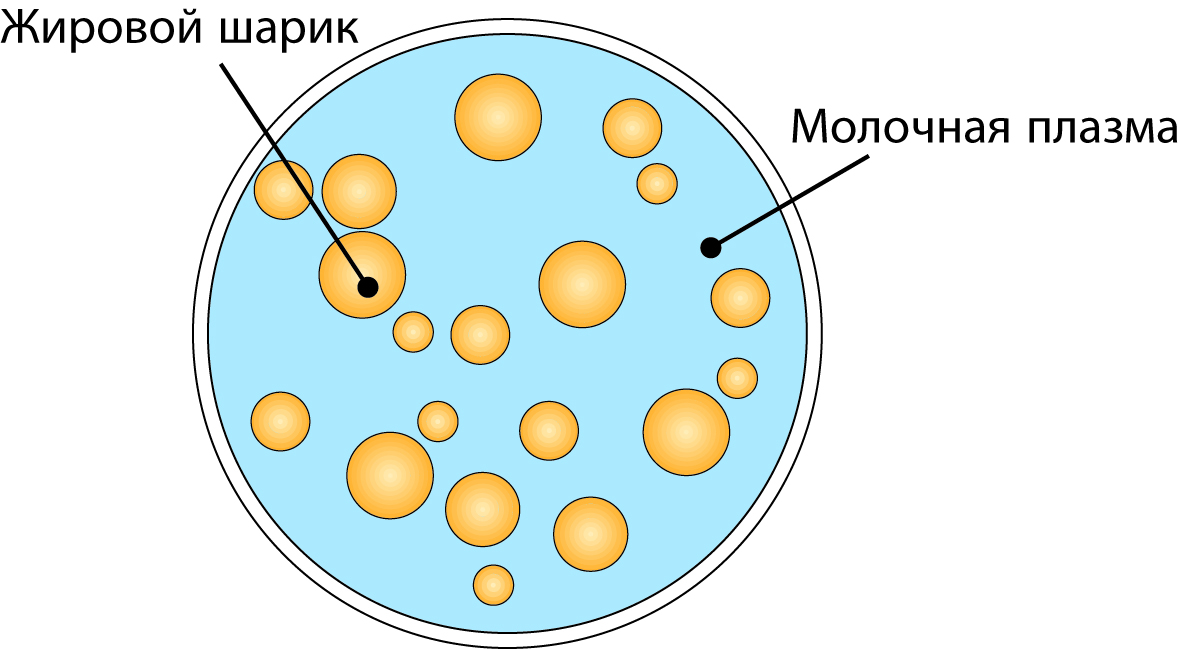
Молоко и сливки являются примерами эмульсий «жирвводе» (или «масло в воде»). Молочный жир присутствует в виде небольших шариков или капель, диспергированных в молочной плазме, рис. 2.15. Их диаметр колеблется в пределах 0,1–20 мкм (1 мкм = 0,001 мм). Средний размер равен 3–4 мкм, и в 1 мл порядка 1010 шариков.
Данная эмульсия стабилизирована очень тонкой мембраной толщиной 5–10 нм (1 нм = 10-9 м), окружающей шарики и имеющей сложный состав.
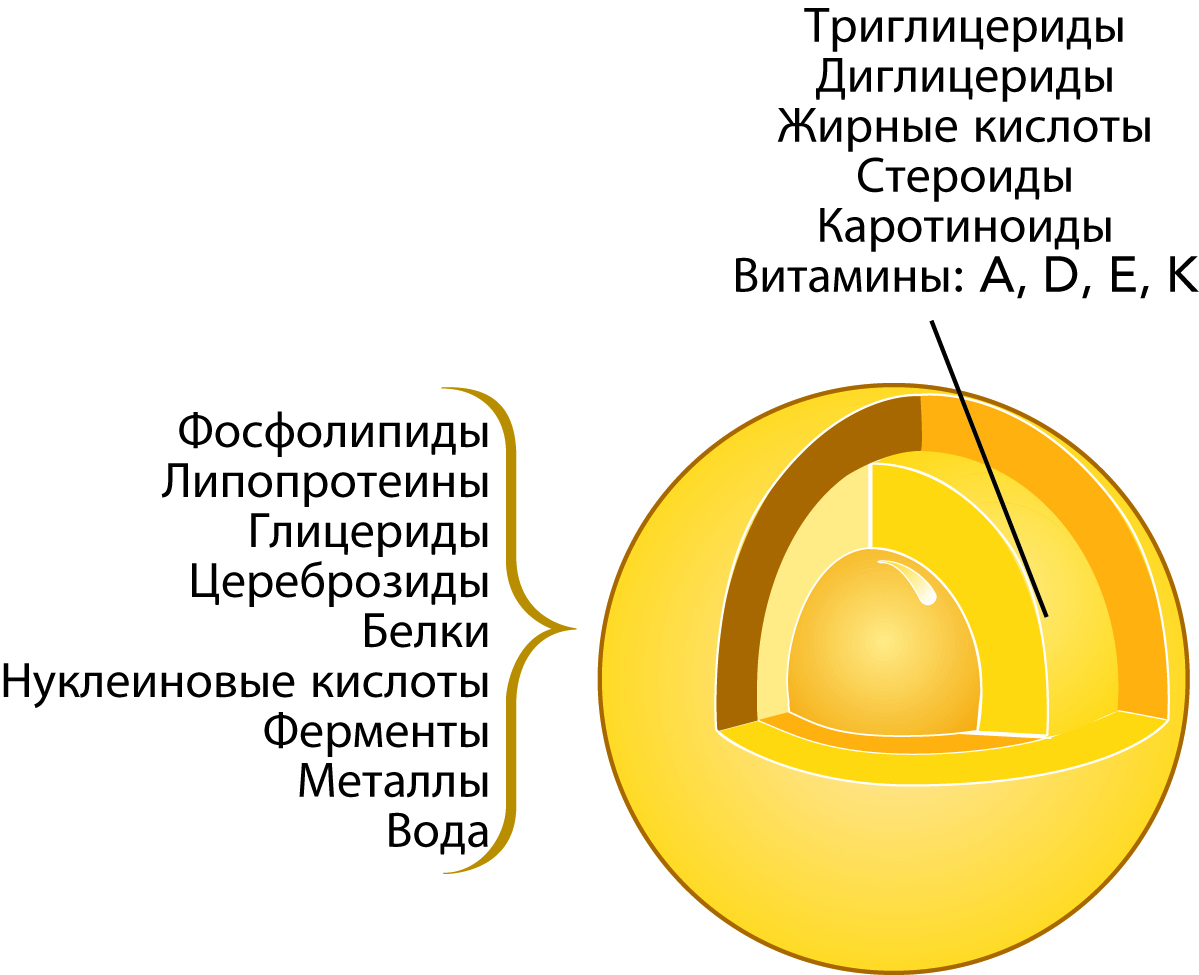
Молочный жир состоит из триглицеридов (доминирующие компоненты), ди- имоноглицеридов, жирныхкислот, стероидов, каротиноидов (обусловливающих желтый цвет жира) и витаминов (A, D, Е и К). Менее значимые компоненты присутствуют в незначительных количествах. Состав шарика молочного жира схематически представлен на рис. 2.16.
Мембрана состоит из фосфолипидов, липопротеинов, цереброзидов, белков, нуклеиновых кислот, ферментов, микроэлементов (металлов) и связанной воды. Необходимо отметить, что состав и толщина мембраны не являются постоянными, так как ее компоненты находятся в постоянном обмене с окружающей молочной плазмой.
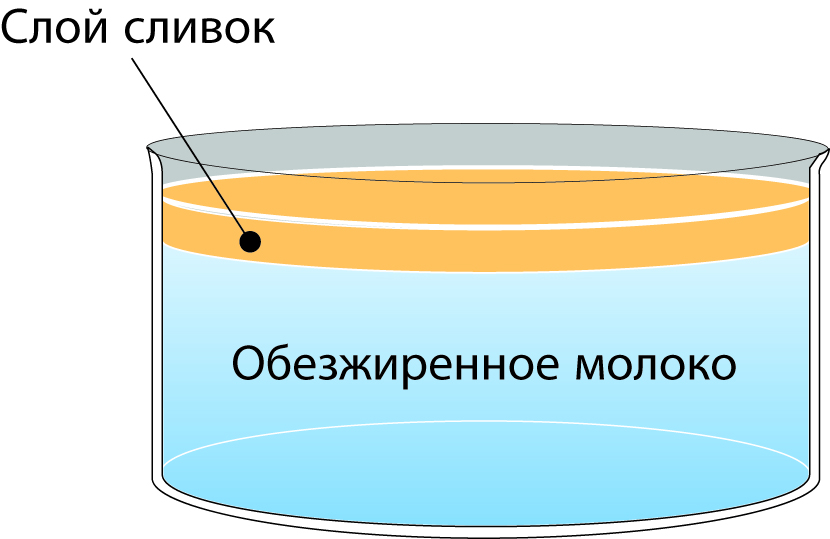
Так как шарики молочного жира являются не только самыми крупными частицами, но и самыми легкими (с плотностью 0,93 г/см3 при 15,5 °С), они имеют тенденцию всплывать к поверхности, если молоку дать в течение некоторого времени отстояться (рис. 2.17).
Скорость подъема жировых шариков подчиняется закону Стокса, но их маленькие размеры замедляют процесс выделения сливок. Однако этот процесс может быть ускорен вследствие агрегации жировых шариков посредством белка, называемого агглютинином. Эти агрегаты поднимаются значительно быстрее, чем отдельные шарики. Они легко разрушаются нагреванием или механической обработкой. Агглютинин меняет свои свойства за 2 минуты при 75 °С и теряет способность к созданию агрегатов.
Химическая структура молочного жира
Когда молоко покидает вымя при температуре 37 °С, молочный жир находится в жидком состоянии. Это означает, что шарики жира легко изменяют форму при умеренном механическом воздействии (например, при подаче молока насосом или при протекании его по трубопроводам) без выхода за пределы мембран.
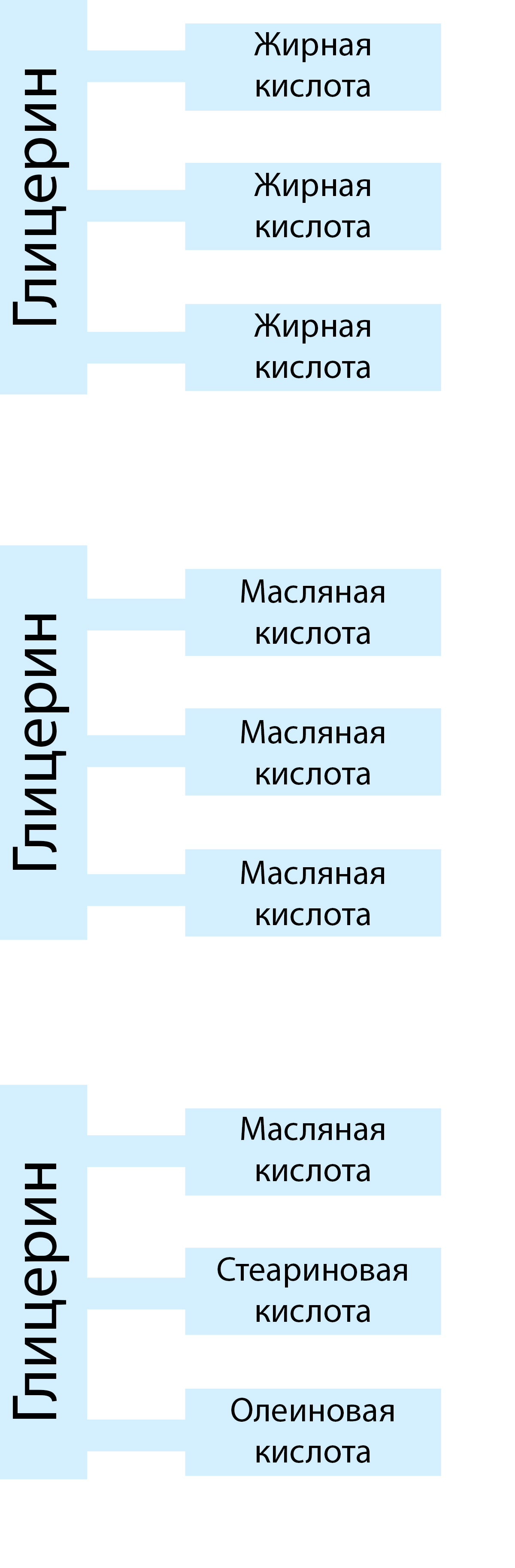
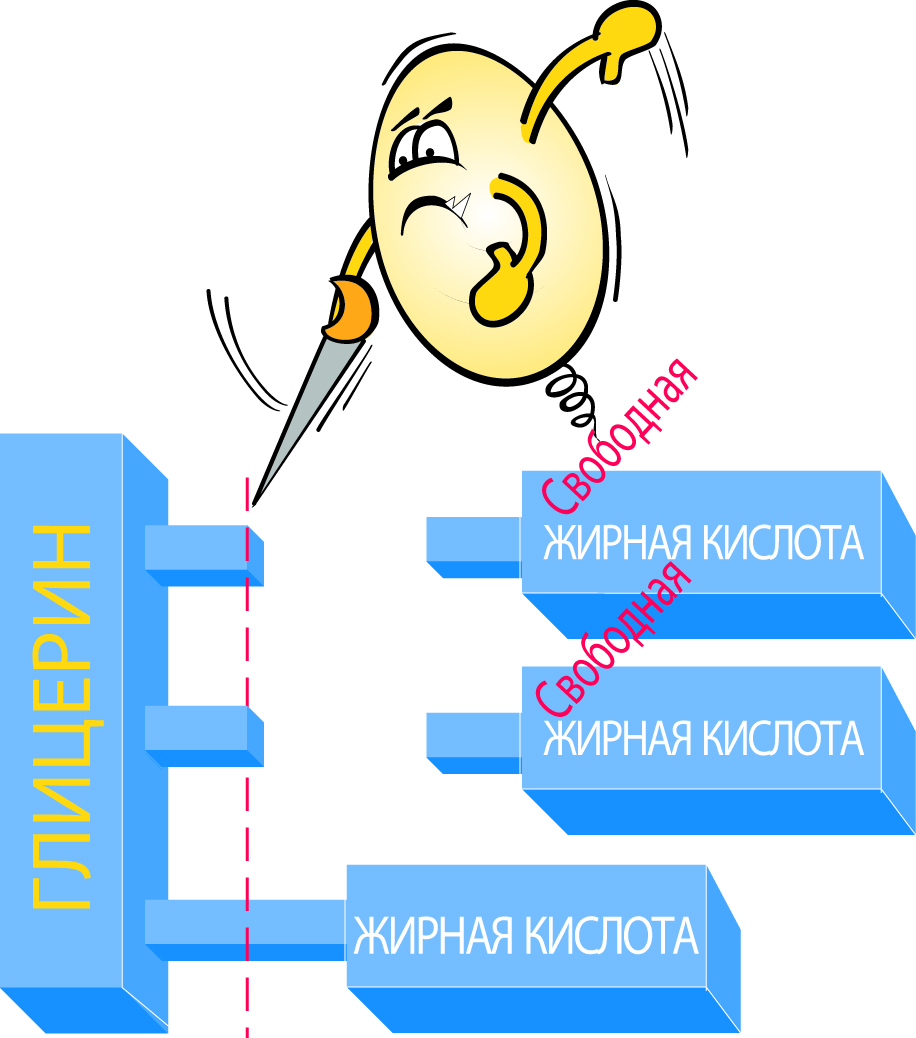
Все жиры относятся к группе веществ, называемых эфирами и представляющих собой соединения спиртов и кислот. Молочный жир является смесью разных эфиров жирных кислот, называемых триглицеридами, которые состоят из спирта, называемого глицерином, и различных жирных кислот. Глицериды составляют до 99% молочного жира.
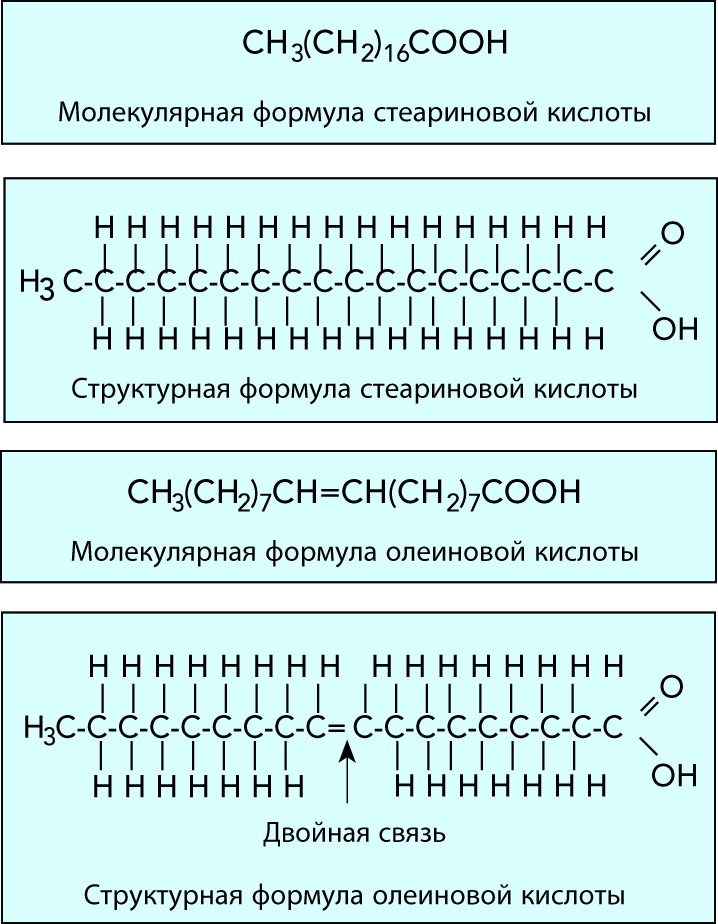
Молекулы жирных кислот состоят из углеводородной цепи и карбоксильной группы (формула RCOOH). В насыщенных жирных кислотах углеродные атомы соединены вместе в цепь простыми связями, в то время как в ненасыщенных жирных кислотах в углеводородной цепи присутствуют и двойные связи, см. рис. 2.19. Каждая молекула глицерина может присоединять три молекулы жирной кислоты, а так как присоединенные кислоты не обязательно являются одинаковыми, это приводит к очень большому разнообразию глицеридов в молоке, см. рис. 2.20.
В таблице 2.4 перечислены наиболее важные жирные кислоты, входящие в триглицериды молока..
Точка плавления жира
Таблица 2.4 показывает, что в молочном жире наиболее широко представлены миристиновая, пальмитиновая, стеариновая и олеиновая кислоты.
Первые три из них при комнатной температуре являются твердыми, а последняя – жидкой. Как показывают приведенные данные, относительное содержание различных жирных кислот может значительно меняться. Это изменение влияет на твердость жира. При этом жир с высоким содержанием высокоплавких кислот, таких как пальмитиновая, будет твердым, с другой стороны, из жира с высоким содержанием низкоплавкой олеиновой кислоты получают мягкое масло.
Определение относительного количества отдельных жирных кислот представляет чисто научный интерес. Для практических же целей достаточно определить одну или несколько констант или индексов, дающих конкретную информацию о составе жира.
Йодное число
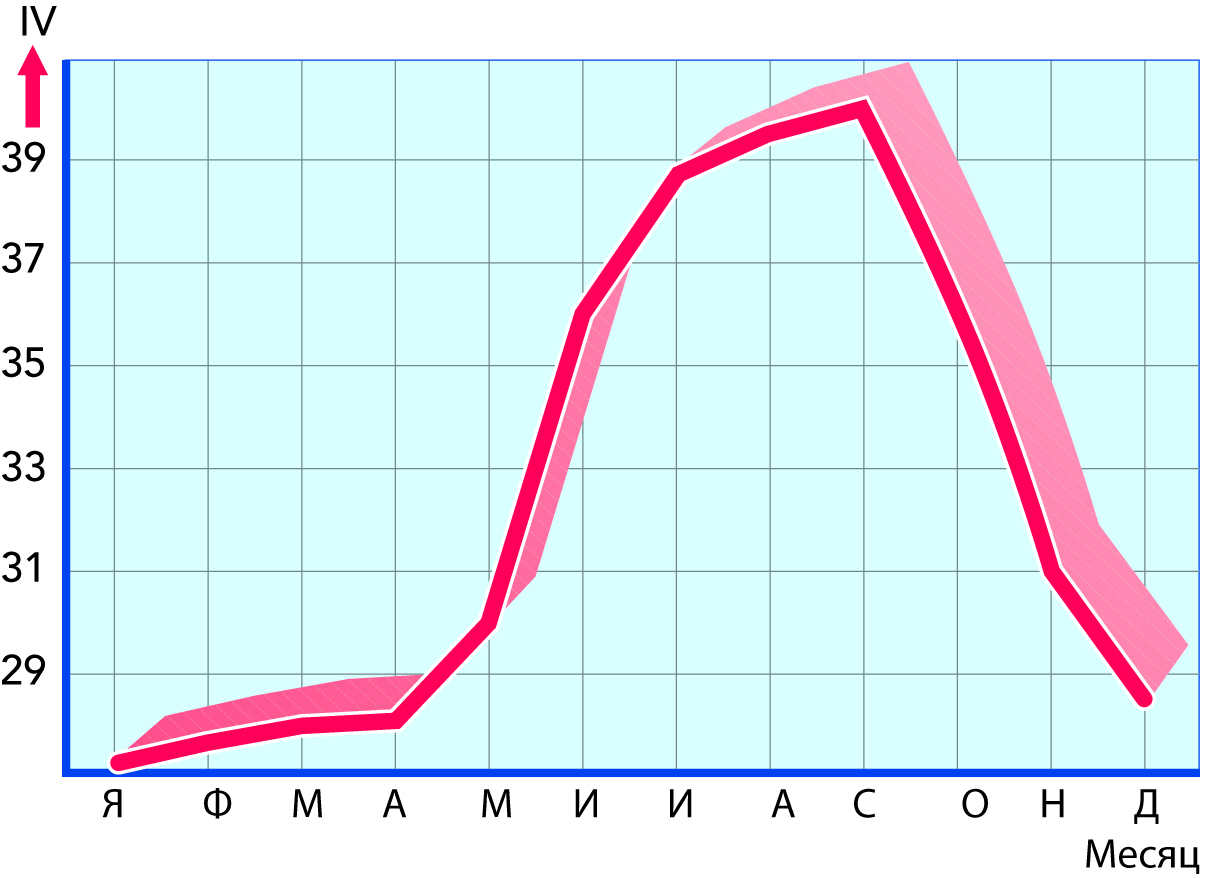
Жирные кислоты содним итем же числом атомов С, но с различным числом простых и двойных связей имеют совершенно различные характеристики. Наиболее важным и наиболее часто применяемым методом индикации их специфических характеристик является измерение йодного числа (ЙЧ) жира. Йодное число означает процент йода, который может связать жир. Йод присоединяется по двойным связям ненасыщенных жирных кислот. Так как одной из самых распространенных из ненасыщенных жирных кислот является жидкая при комнатной температуре олеиновая кислота, то йодное число большей частью является мерой содержания олеиновой кислоты, а значит, и мягкости жира.
Йодное число жировой фракции масла обычно лежит в пределах 24–46. Разброс в значениях определяется кормом коров. Зеленый подножный корм летом вызывает повышение содержания олеиновой кислоты, так что летний молочный жир является мягким (с высоким йодным числом). Некоторые кормовые концентраты, такие как жмых подсолнечника или льняных семян, тоже способствуют получению мягкого жира, в то время как такие типы корма, как жмых кокосовых орехов или пальмового масла или ботва корнеплодов, дают твердый жир. Следовательно, подбором подходящей диеты для коров можно влиять на консистенцию молочного жира.
На рис. 2.21 приведен пример того, как йодное число молочного жира может меняться в течение года (Швеция).
Жир с высоким содержанием высокоплавких жирных кислот является твердым.
Жир с высоким содержанием низкоплавких жирных кислот будет мягким.
Показатель преломления
Количество различных жирных кислот в жире влияет и нато, как он преломляет свет. Поэтому общепринято определять показатель преломления жира, который может быть использован для расчета йодного числа. Это является быстрым способом оценки твердости жира.
Ядерный магнитный резонанс (ямр)
Вместо анализа значений йодного числа или показателя преломления соотношение насыщенного жира к ненасыщенному можно определить при помощи импульсного ЯМР. Используя коэффициент пересчета, полученные данные ЯМР можно при желании преобразовать в соответствующее йодное число.
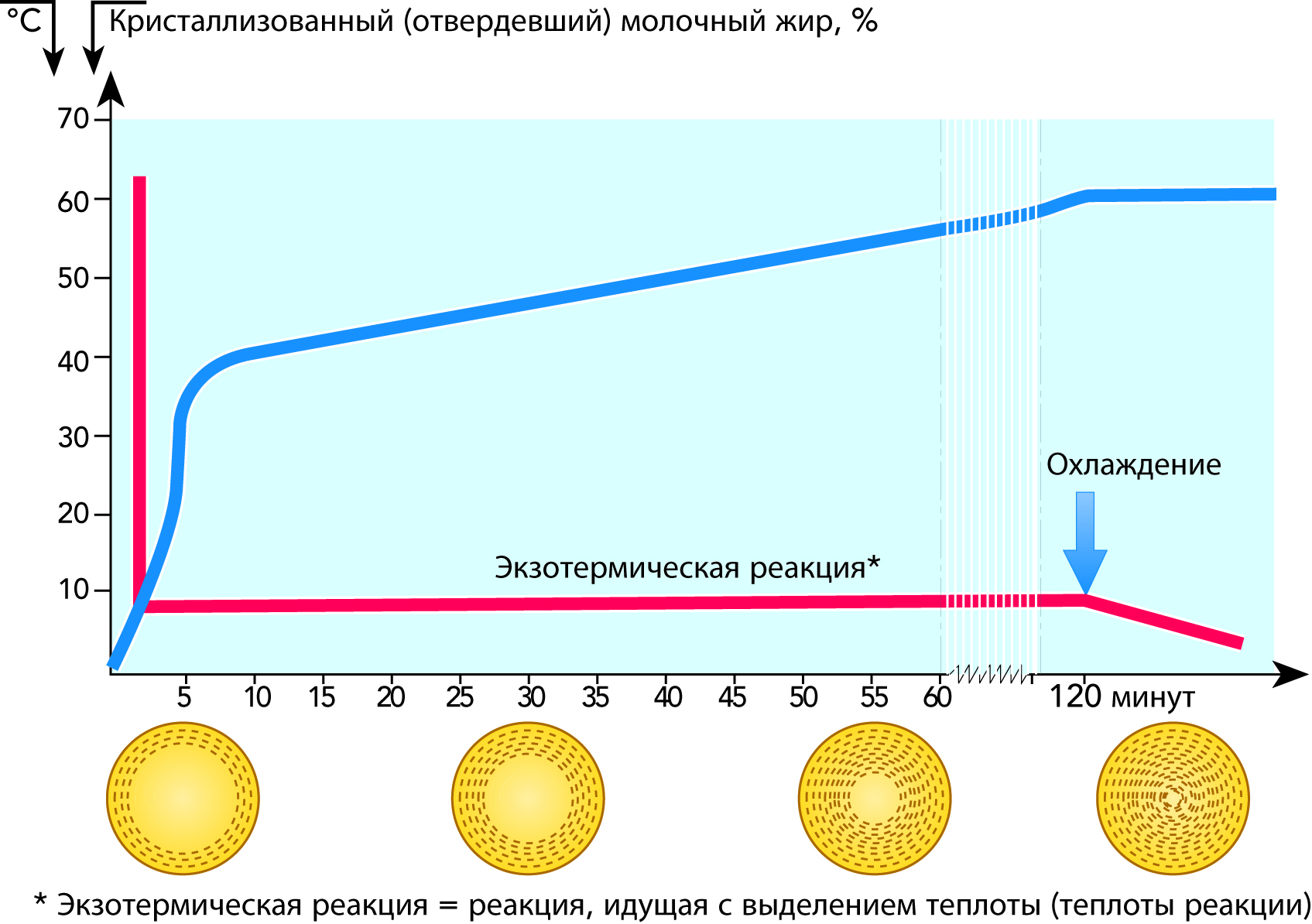
Метод ЯМР может быть также использован и для определения степени кристаллизации жира как функции времени кристаллизации. Было показано, что кристаллизация жира в 40%-х сливках, охлажденных с 60 °С до 5 °С, протекает длительное время. Необходимо не менее 2 часов для достижения процента кристаллизации в 65 % от общего, см. рис. 2.22. Отмечается также, что втечение 2 минут после достижения 5 °С закристаллизовывалось только 15–20 % жира. Показания ЯМР по содержанию ненасыщенных жирных кислот в масле обычно колеблются в пределах 30–41 %.
Кристаллизация жира
В процессе кристаллизации жировые шарики очень чувствительны и легко разрушаются даже при умеренных механических воздействиях.
Исследования, проведенные с помощью электронного микроскопа, показали, что жир кристаллизуется в мономолекулярные сферы, см. рис. 2.22. В это же время происходит фракционирование жира, приводящее к образованию внешних сфер из триглицеридов с самой высокой температурой плавления. Из-за того, что кристаллический жир имеет более низкий удельный объем, чем жидкий жир, внутри шариков жира при кристаллизации возникают напряжения, которые придают им нестабильность и предрасположенность к разрушению во время кристаллизации. Это приводит к выделению жидкого жира в молочную плазму с образованием комочков, в которых свободный жир склеивает целые жировые шарики вместе (такое же явление происходит и при получении масла). Кристаллизация жира идет с выделением теплоты плавления, повышающей немного его температуру (40%-е сливки, охлажденные с 60 до 7–8 °С, в период кристаллизации становятся теплее на 3–4 °С).
Это важное свойство молочного жира необходимо учитывать при получении сливок для различного применения.
Молочные белки
Белки являются существенной частью нашего рациона. Потребляемые нами белки расщепляются на более простые соединения в пищеварительной системе и в печени. Данные соединения затем переносятся к клеткам организма, где они используются в качестве строительного материала для собственных белков организма. В подавляющем большинстве химические реакции, происходящие в организме, регулируются особыми активными белками, называемыми ферментами.
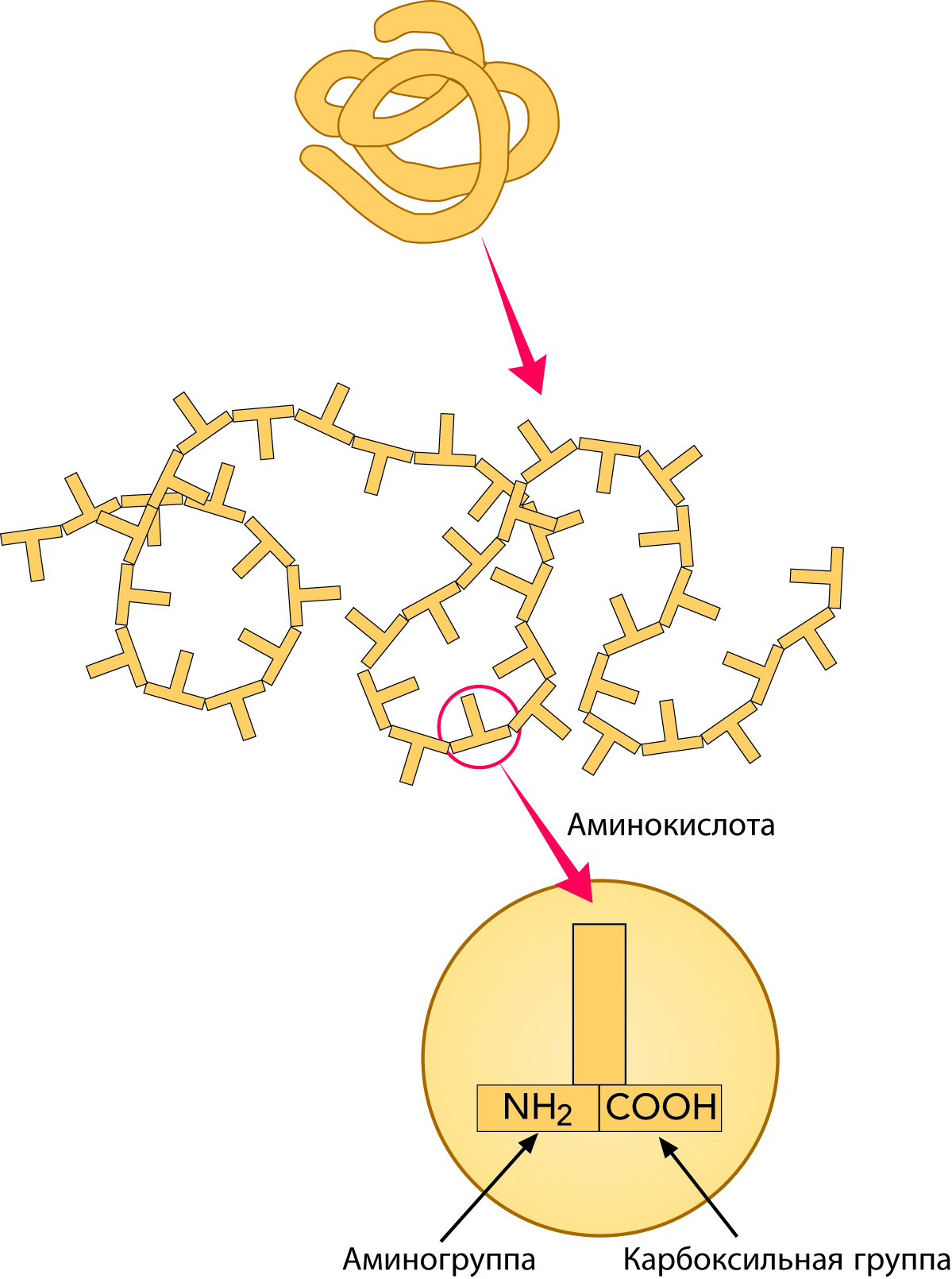
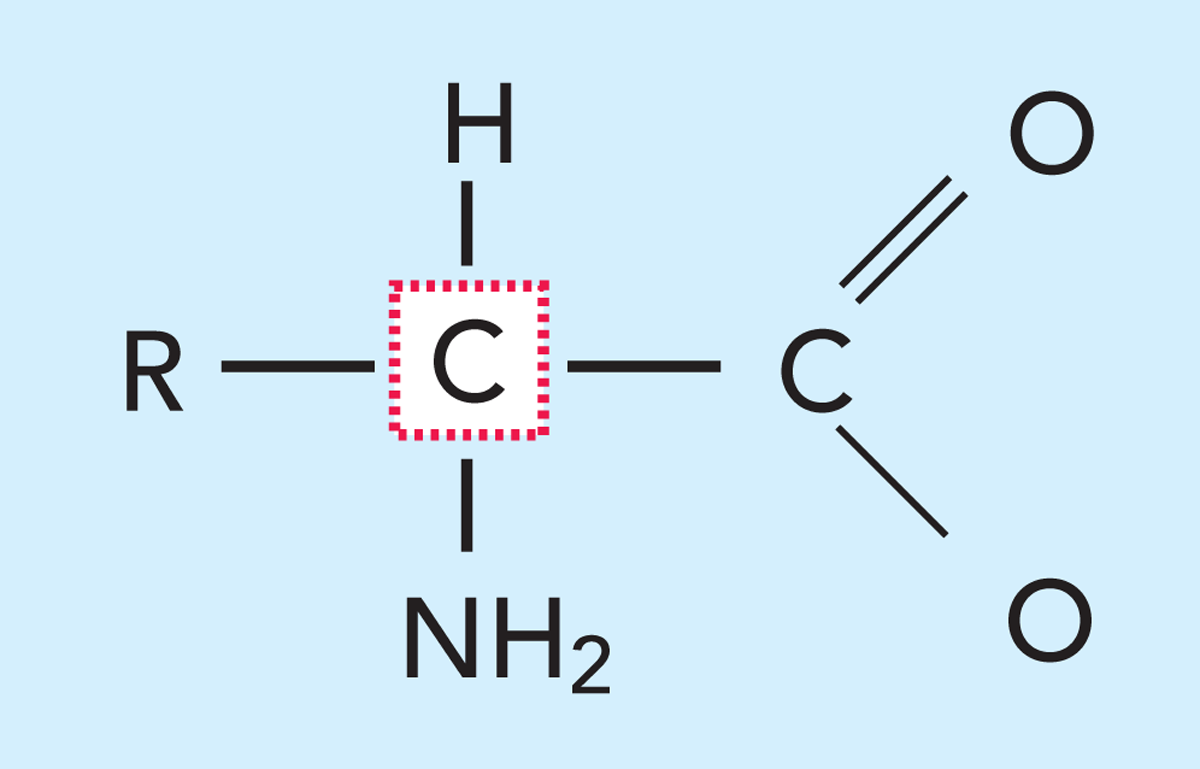
Белки – это гигантские молекулы, состоящие из меньших единиц – называемых аминокислотами, рис. 2.23. Белковая молекула состоит из одной или нескольких цепей с внутренними связями между аминокислотами, расположенными в специфическом порядке. Белковая молекула обычно содержит около 100–200 соединенных аминокислот, хотя известны белки как с большим, так и с меньшим числом аминокислот.
Аминокислоты
Аминокислоты (см. рис. 2.24) являются строительными блоками, образующими белки, и отличаются одновременным присутствием в их молекулах по одной аминогруппе (-NH2) и по одной карбоксильной (-СООН) группе. Белкио бразуются из специфических аминокислот, a-аминокислот, то есть таких, у которых есть и карбоксильная группа, и аминогруппа, присоединенные к одному и тому же углеродному атому – a-углероду. Аминокислоты принадлежат к группе химических соединений, которые могут выделять ионы водорода в щелочных растворах и присоединять эти ионы из растворов кислот. Такие соединения называются амфотерными электролитами, или амфолитами.
Эти аминокислоты могут существовать в трех состояниях:
1 отрицательно заряженными в щелочных растворах;
2 нейтральными при равных количествах положительных и отрицательных зарядов;
3 положительно заряженными в кислотных растворах.
Белки собираются приблизительно из 20 аминокислот. Важным фактом с точки зрения питания является то, что восемь (для детей – девять) из 20 аминокислот не могут быть синтезированы человеческим организмом. Так как они являются необходимыми для поддержания здорового обмена веществ, то непременно должны поступать в организм вместе с пищей. Они называются незаменимыми аминокислотами и как раз все присутствуют в белках молока.
Тип и порядок аминокислот в белковой молекуле определяют природу белка. Любое изменение в типе аминокислот или в местах их расположения в молекулярной белковой цепи может вызвать изменения в свойствах белка.
Так как число возможных комбинаций из 20 аминокислот в цепи, содержащей 100–200 аминокислот, очень велико, тои число белков с различными свойствами также очень велико. На рис. 2.24 приведена модель аминокислоты. Как уже отмечалось, аминокислотысодержат аминогруппу (-NH2) со слабыми основными свойствами и карбоксильную группу (-СООН) со слабыми кислотными свойствами. Эти группы присоединены к боковой цепи (R).
Если боковая цепь полярна, свойство притяжения воды основной и кислотной групп в дополнение к полярной боковой цепочке будет преобладать, то есть вся аминокислота в этом случае будет притягивать воду и легко растворяться в ней. Такую аминокислоту называют гидрофильной (водолюбивой).
С другой стороны, если боковая цепь является углеводородной и не содержит гидрофильных радикалов, то будут доминировать свойства этой цепи. Длинная углеводородная цепь отталкивает воду и делает аминокислоту менее растворимой или менее совместимой с водой. Такая аминокислота называется гидрофобной (водоотталкивающей).
При наличии в углеводородной цепи некоторых радикалов, таких как гидроксильные (-ОН) или аминогруппы (-NH2), ее гидрофобные свойства могут быть изменены в сторону повышения гидрофильности.
Если гидрофобные аминокислоты превалируют в одной части белковой молекулы, эта ее часть будет обладать гидрофобными свойствами. Скопление гидрофильных аминокислот в другой части данной молекулы будет по аналогии придавать ей гидрофильные свойства. Поэтому белковая молекула может быть гидрофильной, гидрофобной, промежуточной или же локально гидрофильной или гидрофобной.
Некоторые белки молока демонстрируют очень большую разницу внутри молекулы в отношении совместимости с водой, при этом некоторые очень важные свойства этих белков зависят от подобных различий.
Гидроксильные группы в аминокислотных цепях у казеина могут быть эстерифицированы фосфорной кислотой. Такие группы придают способность казеину связывать ионы кальция или коллоидный гидроксифосфат кальция с образованием прочных мостиковых связей внутри белковых молекул или между ними.
Электрическое состояние белков молока
Боковые цепи некоторых аминокислот белков молока несут электрический заряд, зависящий от рН молока. Когда рН изменяется при добавлении кислоты или основания, изменяется также и распределение заряда белка. Электрическое состояние белков и связанные с ним свойства проиллюстрированы на рис. с 2.25 по 2.28.
При обычной рН молока (≈6,7) белковая молекула имеет общий отрицательный заряд, рис. 2.25. Молекулы белка остаются разделенными из-за отталкивания идентичных зарядов. При добавлении ионов водорода (рис. 2.26) они адсорбируются белковыми молекулами. При величине рН, при которой положительный заряд белка становится равен отрицательному заряду (когда число групп NH3+ и COO- в боковых цепях одинаково), общий заряд белка будет нулевым. Белковые молекулы больше не отталкиваются друг от друга, а положительные заряды одной молекулы притягиваются отрицательными зарядами соседних молекул, что приводит к образованию огромных белковых скоплений. После этого белок выпадает из раствора в осадок. Величина рН, при которой происходит это явление, называется изоэлектрической точкой данного белка.
При наличии избытка водородных ионов белковые молекулы приобретают общий положительный заряд, как показано на рис. 2.27. Это снова приводит к взаимному отталкиванию белковых молекул, и, следовательно, они остаются в растворе.
С другой стороны, при добавлении раствора сильной щелочи (NaOH) все белки приобретают отрицательные заряды и растворяются.
Классификация белков молока
Молоко содержит сотни видов белков, большинство из которых присутствует в очень незначительных количествах. Белки можно классифицировать разными способами на основе их химических или физических свойств и биологических функций. Старый способ разделения белков на казеины, альбумины и глобулины дает путь к более адекватной системе их классификации. В таблице 2.5 приведен сокращенный список белков молока в соответствии с современной системой. Незначительные группы белков при этом для простоты были исключены.
Понятие «сывороточный белок» часто используют в качестве синонима для белков молочной плазмы, но его нужно было бы зарезервировать для белков сыворотки, получаемой в процессе приготовления сыра. В добавление к белкам молочной сыворотки сывороточный белок содержит и фрагменты молекул казеина. Некоторые белки молочной сыворотки присутствуют в меньшей концентрации, чем в исходном молоке. Это обусловлено тепловым разложением при пастеризации молока в процессе производства сыра. Три основные группы белков в молоке значительно различаются между собой характеристиками и свойствами. Казеины могут легко осаждаться в молоке различными способами, в то время как белки сыворотки обычно остаются в растворе. Белки оболочки жировых шариков, как и положено им по названию, прилипают к поверхности этих шариков и выделяются только при механическом воздействии, например при сбивании сливок в масло.
Казеин
Казеин представляет собой смесь нескольких компонентов (таблица 2.5) и является преобладающим классом белков молока, содержащим примерно четыре-пятых всех белков молока. Существуют четыре основных подгруппы казеинов: as1-казеин, as2-казеин, k-казеин и b-казеин, каждая из которых является гетерогенной и состоит из нескольких генетических вариантов. Генетические варианты белка отличаются друг от друга только небольшим количеством аминокислот.
Эти казеины самоассоциируются и образуют большие комплексы, называемые мицеллами. Эти мицеллы состоят из сотен и тысяч отдельных молекул казеиновых белков и имеют размер от 50 до 500 нм. Так как мицеллы имеют коллоидные размеры, они могут рассеивать свет, а белая окраска снятого молока в значительной степени вызвана рассеянием света на мицеллах казеина.
Мицеллы казеина
Мицеллы казеина оказывают важное влияние на свойства молока. Они в значительной степени определяют физическую стабильность молочных продуктов при нагревании и хранении, играют ключевую роль при приготовлении сыра и определяют реологические свойства ферментированных и концентрированных молочных продуктов.
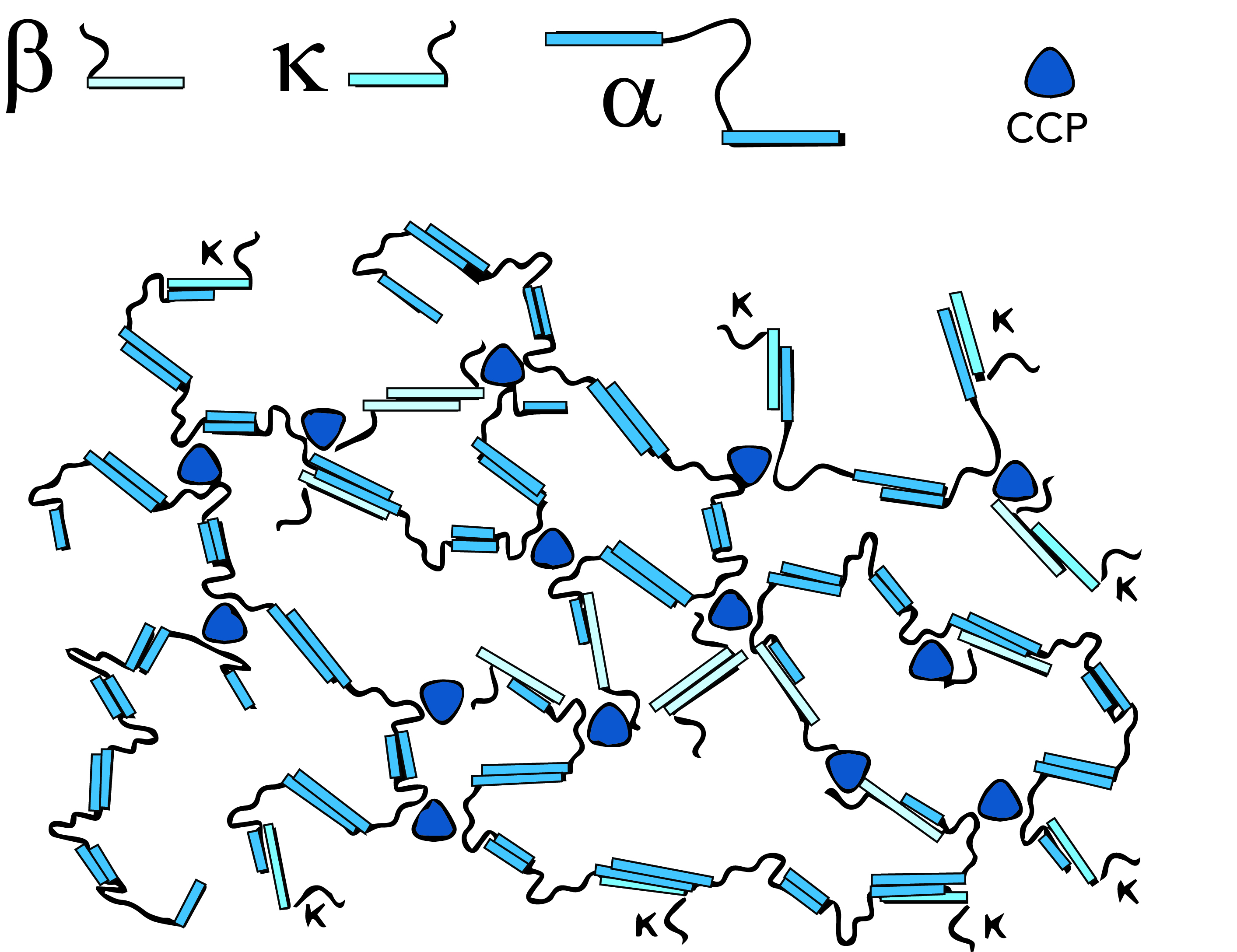
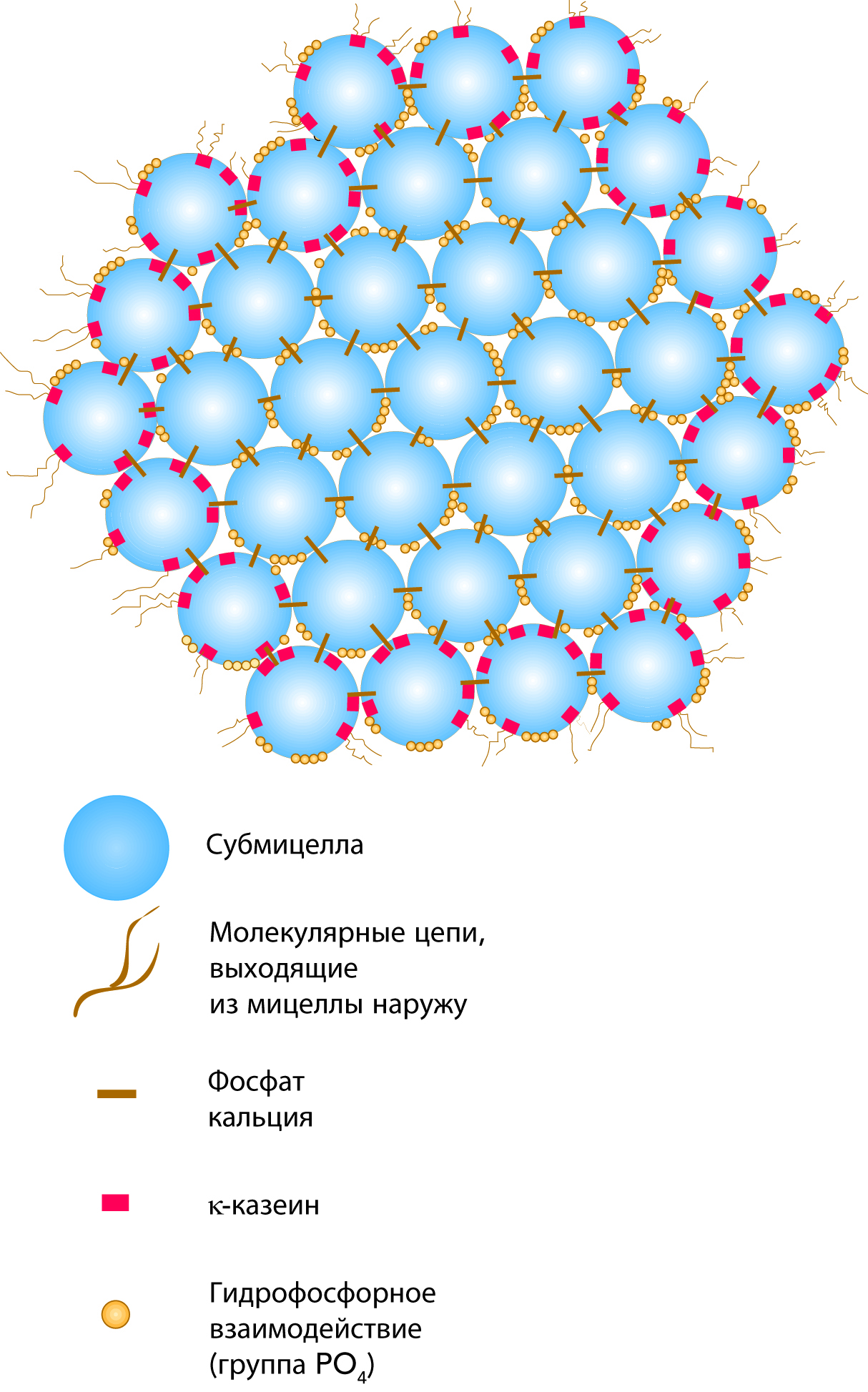
Мицеллы казеина являются довольно плотными агрегациями с небольшими включениями фосфата кальция, который связывает мицеллы вместе, придавая мицеллам открытую пористую структуру. Удаление фосфата кальция (КФК – коллоидный фосфат кальция), например путем закисления или добавления ЭДТA или цитратов, ведет к распаду мицелл. Распад также происходит, когда рН начинает превышать 9. Внутренняя структура мицелл казеина обсуждается уже долгое время и все еще до конца не понята. Предлагаются три основные модели: нанокластерная модель, модель двойного связывания и модель субмицеллы.
Однако в отношении некоторых характеристик единое мнение существует. Мицеллы представляют собой примерно сферические частицы со средним диаметром порядка 150 нм при значительном разбросе размеров. as- и b-казеины в основном сконцентрированы в середине мицеллы, а k-казеины большей частью расположены на поверхности. Вокруг мицеллы существует «ворсинчатый слой», состоящий в основном из С-окончаний k-казеина, выступающих на 5–10 нм за поверхность мицеллы. Эта выступающая k-казеиновая цепь является гидрофильной, отрицательно заряженной и вносит основной вклад в пространственную стабильность мицелл. Если удалить ворсинчатый слой, например добавив этанол или через ферментативный гидролиз под действием сычужного фермента, коллоидная стабильность мицеллы меняется, и мицеллы или агрегируют, или выпадают в осадок. Кроме того, общепризнано, что имеются нанокластеры фосфата кальция, обычно около 3 нм в диаметре, содержащие основную часть кальция и фосфатов, имеющихся в мицелле. Силы, удерживающие мицеллыотраспада, представляют собой гидрофобные взаимодействия между белковыми группами, а также связывание между пептидными цепочками за счет нанокластеров и ионных связей.
Нанокластерная модель (рис. 2.29, Holt, 1992, De Knuif и Holt, 2003) представляет собой сложную сеть гибких казеиновых молекул, образующую желеобразную структуру, связываемую нанокластерами фосфата кальция.
Модель двойного связывания (рис. 2.30) была предложена Хорном (1998), который предположил, что мицеллы удерживаются от распада в результате баланса как гидрофобных взаимодействий между молекулами казеина, так и связи с коллоидным фосфатом кальция.
Модель субмицеллы (Морр, 1967; Слеттери и Эвард, 1973; Вальстра, 1999) предполагает, что мицеллы казеина состоят из меньших мицелл, субмицелл, около 10–15 нм в диаметре, соединяемых между собой кластерами фосфата кальция, см. рис. 2.31.
Структура мицелл казеина является не жесткой, а динамической. Мицеллы казеина постоянно обмениваются компонентами с окружающей средой. Они реагируют на изменения в среде вокруг мицеллы – в температуре, уровне рН и давлении.
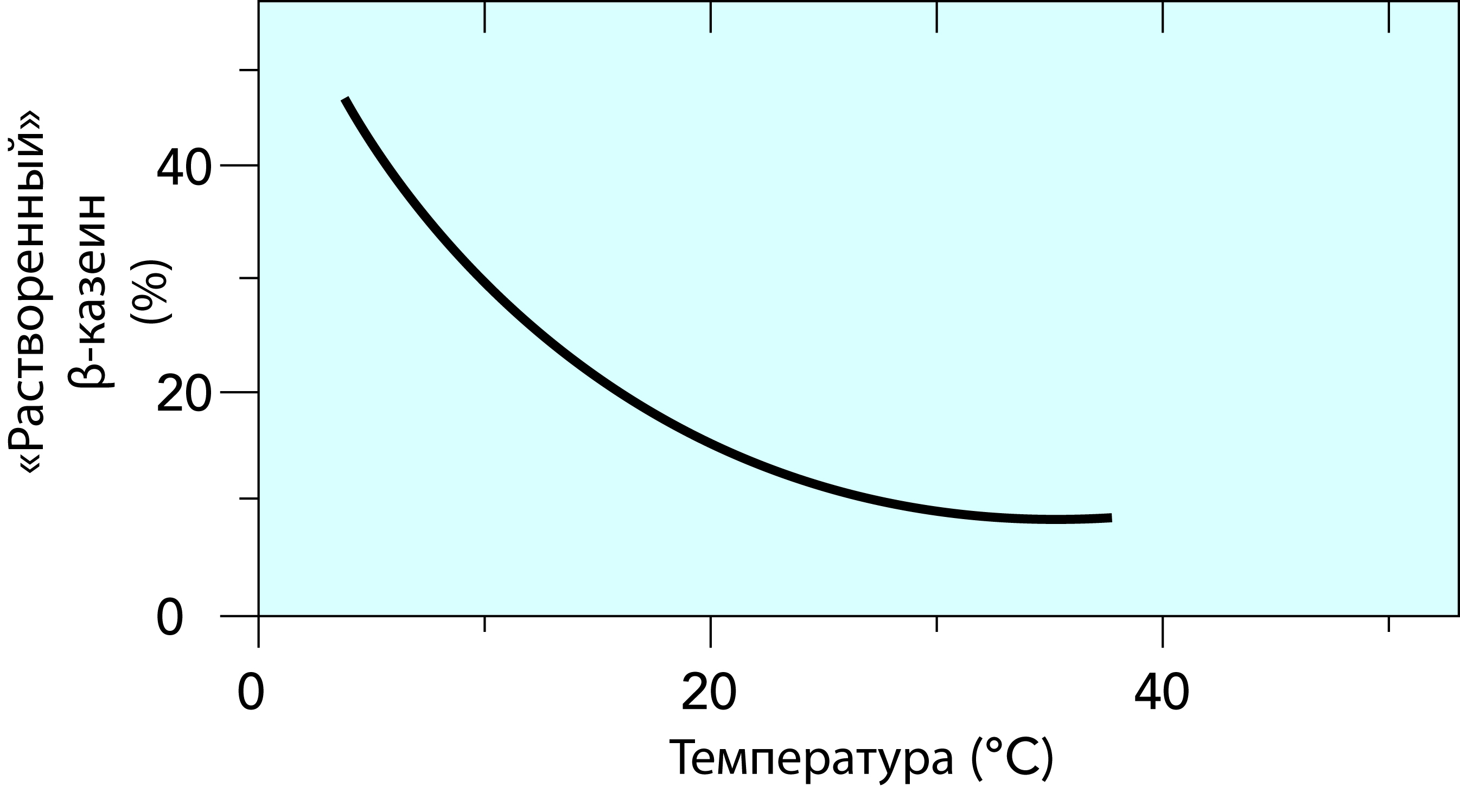
При удалении гидрофильного С-окончания k-казеина на поверхности мицелл, например под действием сычужного фермента, мицеллы теряют растворимость и начинают агрегировать с образованием казеинового сгустка. В неповрежденных мицеллах имеется избыток отрицательных зарядов, и потому они взаимно отталкиваются. Молекулы воды, удерживаемые гидрофильными участками k-казеина, являются важной частью этого равновесия. При удалении этих гидрофильных участков вода начинает покидать структуру. Это открывает простор для действия сил притяжения. Образуются новые связи, например солевого типа с активным кальцием и гидрофобного типа. Образование связи приводит к вытеснению воды, и вся структура в конце концов осаждается с образованием плотного сгустка. Низкая температура отрицательно воздействует на мицеллы, вызывая диссоциацию цепей b-казеина и удаление КФК из их структуры, в которой он присутствует в коллоидном виде, в раствор. Объяснение этого явления состоит в том, что b-казеин является наиболее гидрофобной фракцией казеина и гидрофобные взаимодействия ослабляются при понижении температуры. Мицеллы начинают распадаться, и объемность мицелл казеина увеличивается. Потеря КФК приводит к ослаблению взаимодействия между отдельными молекулами казеина. Это изменения делают молоко менее пригодным для производства сыра, так как они вызывают замедление сычужного свертывания и образование более мягкой сырной массы. b-казеин, кроме того, после выхода из мицеллы легче подвергается гидролизу различными протеазами, содержащимися в молоке. Гидролиз b-казеина до g-казеина и протеозопептонной фракции приводит к более низкому выходу получаемого сыра из-за того, что протеозопептонные фракции отходят в сыворотку. Распад b-казеина может также привести к образованию горьких пептидов, приводящих к ухудшению вкусовых качеств молочных продуктов.
Подобные изменения происходят медленно, на их окончание уходит около 24 часов при температуре 5 °C. График на рис. 2.32 показывает приблизительное количество фракции b-казеина (в %), выделяющегося из мицелл казеина в течение 24 часов хранения. При последующем нагревании сырого или охлажденного пастеризованного молока до 62–65 °С втечение 20 секунд b-казеин и гидроксифосфат кальция частично возвращаются в мицеллы, вызывая по меньшей мере частичное восстановление исходных свойств молока.
При повышении этой температуры мицеллы частично уменьшаются в объеме, и возрастает количество КФК. Когда в нагревании участвуют сывороточные белки, эти сывороточные белки в результате их тепловой денатурации начинают соединяться с мицеллами казеина, в основном прикрепляясь к поверхности мицелл. Одним из примеров является соединение b-лактоглобулина с k-казеином при термической обработке. Основная часть подобных соединений не возвращается в исходное состояние путем охлаждения.
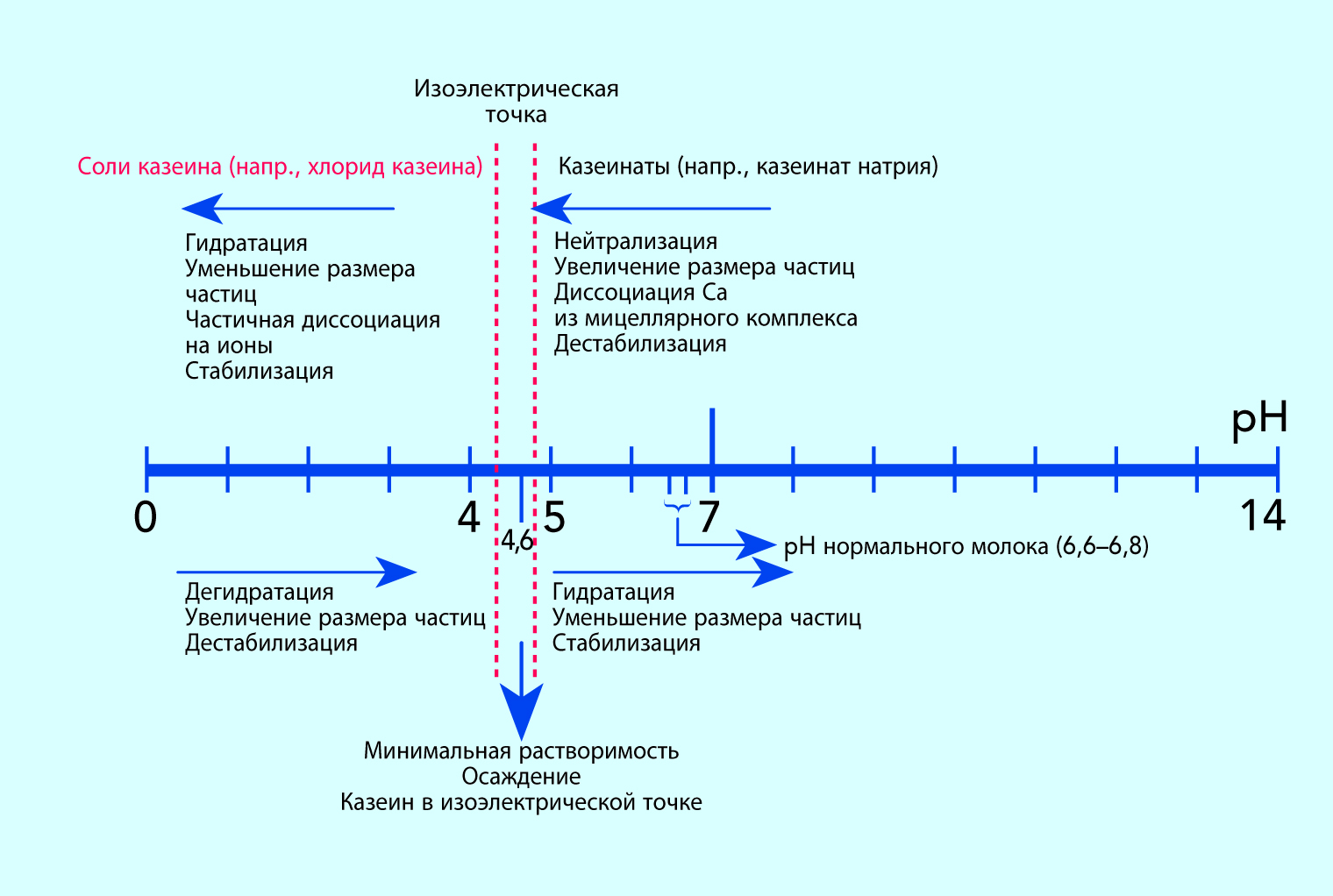
Осаждение казеина
Одним из характерных качеств казеина является его способность к осаждению. С учетом сложной природы молекул казеина и образующихся из них мицелл это осаждение может быть вызвано многими различными агентами. Необходимо помнить о том, что существует большая разница между оптимальными условиями осаждения для казеина в мицеллярной и немицеллярной форме, например в виде казеината натрия. Последующее описание относится в основном к осаждению мицеллярного казеина.
- осаждение кислотой;
- осаждение ферментами.
Осаждение кислотой
При добавлении кислоты в молоко или при росте в нем бактерий, продуцирующих кислоту, понижается рН молока. При этом происходят изменения среды, окружающей мицеллы. Ход событий проиллюстрирован на рис. 2.33. Во-первых, коллоидный гидрофосфат кальция, присутствующий в мицеллах казеина, растворяется с образованием ионов кальция, проникающих в структуру мицелл, и создает прочные внутренние кальциевые связи. Во-вторых, рН раствора достигает изоэлектрических точек отдельных видов казеина.
Оба эти процесса инициируют изменения внутри мицелл, начиная с их роста путем агрегации и заканчивая более или менее плотным коагулятом. В зависимости от конечного значения рН коагулят будет содержать казеин в виде соли и/или казеин в его изоэлектрическом состоянии.
Изоэлектрические точки компонентов казеина зависят от присутствия в растворе других ионов. Теоретические величины рН, действующие при определенных условиях, находятся в диапазоне 5,1–5,3. В солевых растворах при условиях, схожих с теми, которые характерны для молока, интервал кислотности для оптимального осаждения составляет рН 4,5–4,9. На практике ее величина для осаждения казеина из молока составляет 4,6.
При добавлении избыточных количеств гидроксида натрия в осажденный казеин вновь растворенный казеин будет превращаться в казеинат натрия, частично диссоциированный на ионы. Кисломолочные продукты имеют обычно рН в пределах 3,9–4,5, лежащий в кислой области интервала изоэлектрических точек. При получении казеина из обезжиренного молока добавлением серной или соляной кислоты часто выбирают рН, равный 4,6.
Примечание. При добавлении излишнего количества кислоты к данному коагуляту казеин вновь растворится, образуя соли данной кислоты. При использовании хлороводородной кислоты раствор будет содержать гидрохлорид казеина, частично диссоциированный на ионы.
Осаждение ферментами
Аминокислотная цепь, образующая молекулу k-казеина, состоит из 169 аминокислот. С ферментной точки зрения связь между аминокислотами 105 (фенилаланин) и 106 (метионин) легко уязвима для многих протеолитических ферментов.
Некоторые из них атакуют эту связь и расщепляют цепь. Образующийся концевой аминосодержащий фрагмент содержит аминокислоты от 106-й до 169-й, среди которых преобладают полярные аминокислоты, атакже углевод, что придает этой последовательности гидрофильные свойства. Эта часть молекулы k-казеина, называемая гликомакропептидом, уходит в сыворотку при изготовлении сыра.
Остальная часть k-казеина, состоящая из аминокислот от 1-й до 105-й, нерастворима иостаетсявсырноймассевместес as- и b-казеинами. Эту часть называют пара-k-казеином. Формирование сгустка обусловлено резким удалением гидрофильных макропептидов и последующим дисбалансом внутримолекулярных сил. В результате начинается развитие и усиление связи между гидрофобными участками цепи за счет кальциевых связей, образующихся, по мере того как молекулы воды, содержащиеся в мицеллах, начинают покидать структуру. Данный процесс обычно называют стадией коагуляции и синерезисом. Расщепление связи 105–106 в молекуле k-казеина часто называют первичной стадией действия сычужного фермента, а стадию коагуляции и синерезиса – второй стадией процесса. Имеется также третья стадия этого процесса, при которой сычужный фермент воздействует на компоненты казеина более обычным путем. Это происходит при созревании сыра. Продолжительность всех трех стадий определяется главным образом значением рН и температурой. Кроме того, вторая стадия сильно зависит от концентрации ионов кальция и от присутствия или отсутствия сывороточных белков молока на поверхности мицелл.
Сывороточные белки
Сывороточными белками обычно называют белки молочной сыворотки.
При удалении казеина из обезжиренного молока каким-либо методом осаждения (таким, как добавление неорганической кислоты) в жидкости остается группа белков, которые и называют белками молочной сыворотки. До тех пор, пока они не будут подвергнуты денатурации нагреванием, они не осаждаются в их изоэлектрических точках.
При нагревании молока некоторые сывороточные белки денатурируют и образуют комплексы с казеином, понижая способность казеина подвергаться воздействию сычужного фермента и присоединять кальций. Сырная масса из молока, прошедшего высокотемпературную обработку, не выделяет сыворотку, как это происходит обычно с сырным сгустком, из-за меньшего в этом случае числа связей в виде мостиков внутри молекул казеина и между ними.
Сывороточные белки вообще и, в частности, a-лактальбумин имеют очень высокую питательную ценность. Их аминокислотный состав очень близок к тому, что считается биологическим оптимумом. Производные сывороточных белков широко применяются в пищевой промышленности.
A-лактальбумин
Этот белок можно считать типичным сывороточным белком. Он присутствует в молоке всех млекопитающих и играет важную роль в синтезе лактозы в вымени.
B-лактоглобулин
Этот белок найден только у копытных животных и является основным компонентом сывороточных белков молока коров. При нагревании молока выше 60 °С начинается его денатурация, в которой реакционная способность серосодержащей аминокислоты b-лактоглобулина играет заметную роль. Начинают образовываться серные мостики между молекулами b-лактоглобулина, между b-лактоглобулином и k-казеином и между b-лактоглобулиноми a-лактальбумином. При высоких температурах во время этого процесса начинают постепенно выделяться такие соединения серы, как сероводород. Эти серные соединения отвечают за появление привкуса «кипяченого молока» у молока, прошедшего термическую обработку.
Сывороточными белками являются:
a-лактальбумин;
b-лактоглобулин;
сывороточный альбумин;
иммуноглобулин.
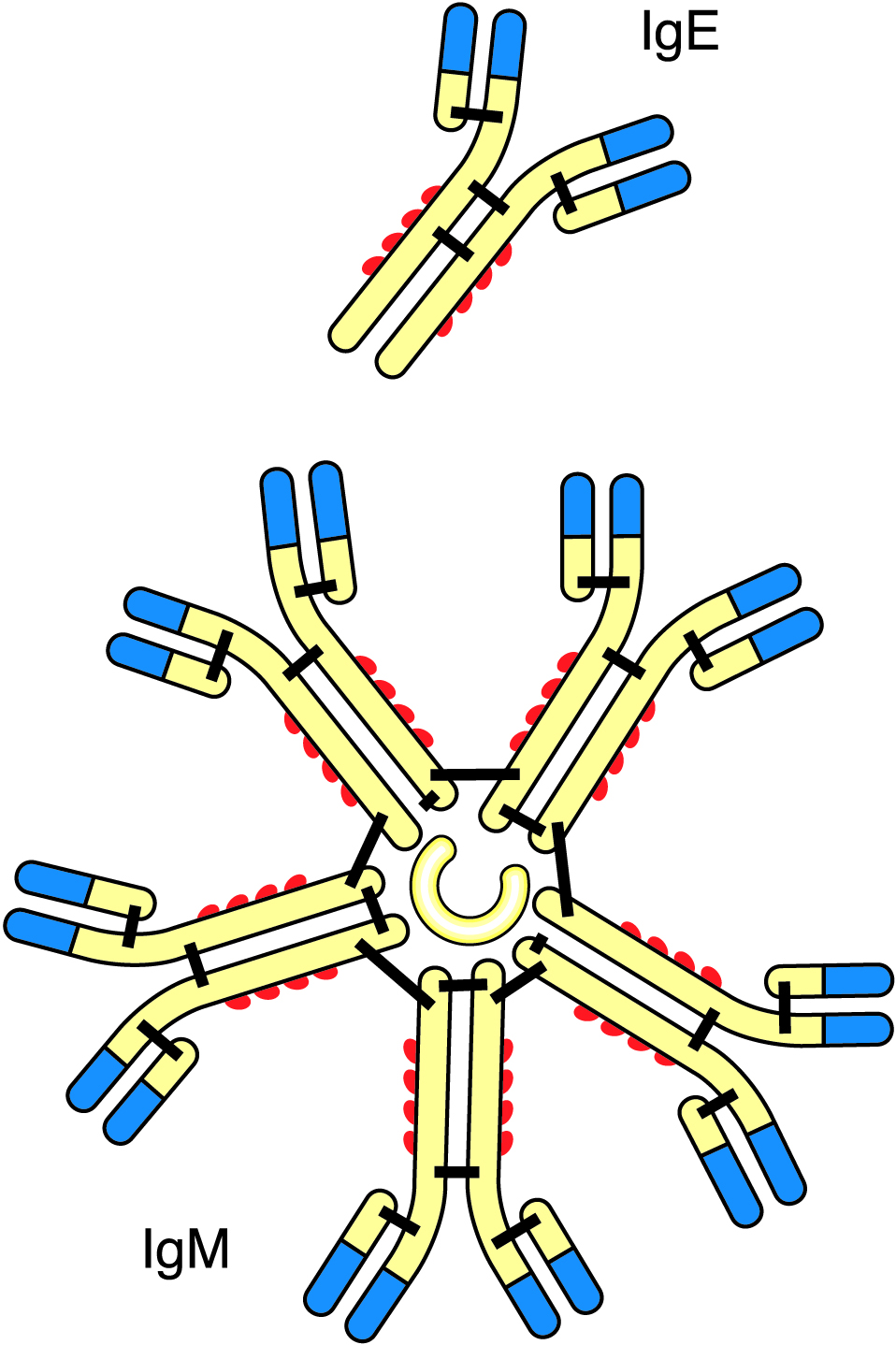
Иммуноглобулины и родственные минорные белки
Эта группа белков чрезвычайно неоднородна, причем детально изучено лишь незначительное число ее представителей, рис. 2.34.
Иммуноглобулины представляют собой антитела, синтезируемые в результате стимулирования конкретными специфическими антигенами. Они, как правило, присутствуют в крови. Их содержание в коровьем молоке невысоко, но некоторые из них присутствуют в высоких концентрациях в молозиве и молоке человека. Они также могут бороться с «частицами», такими как бактерии, вирусы, и даже с шариками жира и осаждать их, эта реакция называется агглютинацией. Таким образом, бактерии также могут осаждаться на шариках жира и собираться в слое сливок. При осаждении микроорганизмов их рост и активность могут быть значительно снижены. Реакция агглютинации избирательна по отношению к конкретным антигенам. Однако некоторые агглютинаты неизбирательные, особенно в случае так называемой криопреципитации – агглютинации, происходящей в холодном молоке при температурах ниже 37 °C. Участвующие белки называются криоглобулинами. Эти агглютинины инактивируются термообработкой, и их способность осаждать частицы исчезает. В результате агглютинация не происходит в пастеризованном молоке.
В будущем из молочной сыворотки, возможно, будут выделяться в промышленных масштабах многие полезные вещества. Лактоферрин и лактопероксидаза являются веществами, которые потенциально могут найти применение в фармацевтической и пищевой промышленности ив настоящее время выделяются из сыворотки в промышленных масштабах. Лактоферринтакже является ингибитором бактерий, включая B. stearothermophilus и сенную палочку. Ингибирование происходит за счет удаления железа из их сыворотки.
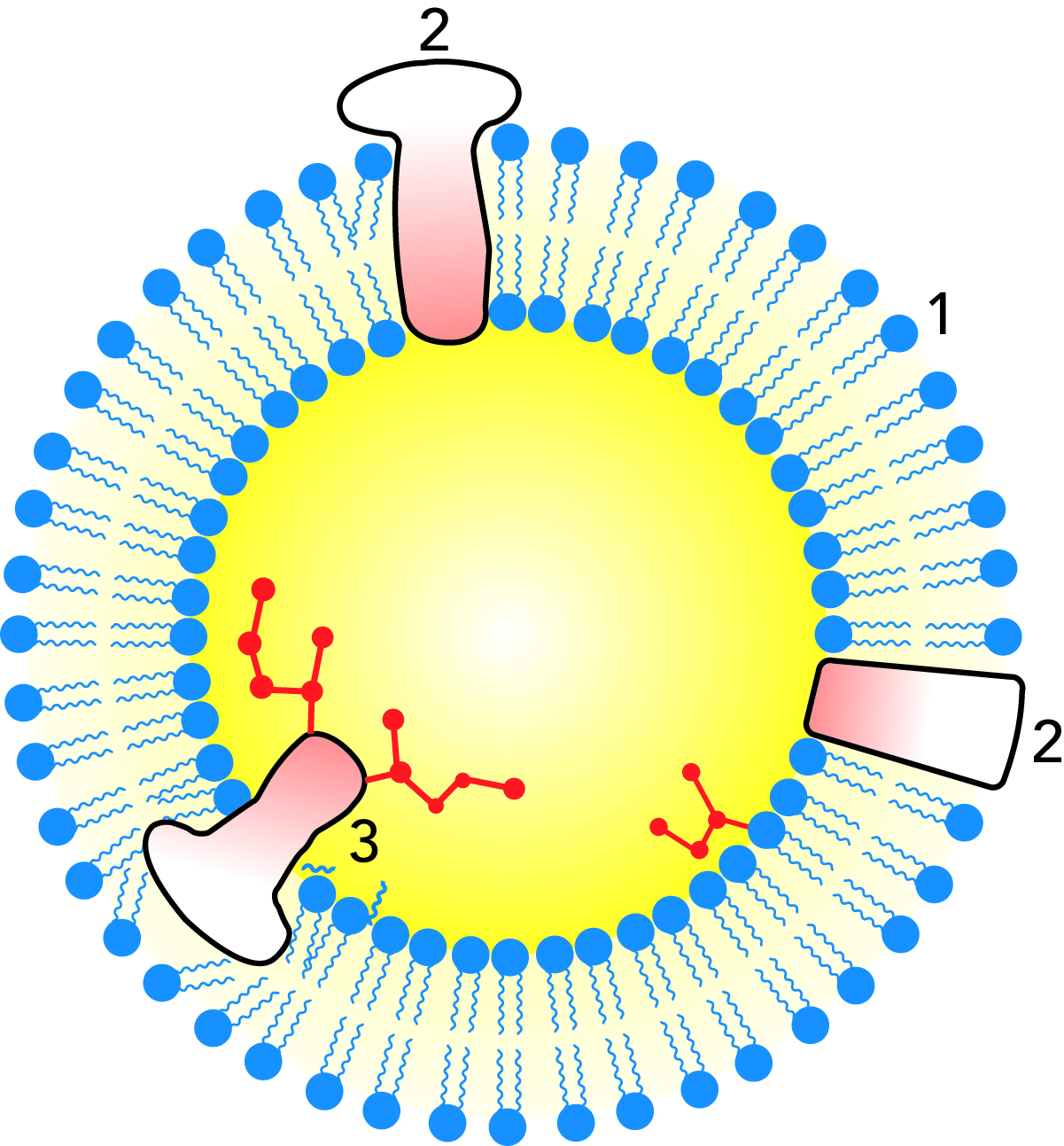
Мембранные белки
Мембранные белки – это группа белков, которые образуют защитный слой вокруг шариков жира для стабилизации его эмульсии, рис. 2.35. Их консистенция варьируется в пределах от мягкой и желеобразной для одних мембранных белков и до довольно плотной итвердой – для других. Некоторые из этих белков содержат липидные остатки и называются липопротеинами. Их липиды и гидрофобные аминокислоты направляют гидрофобные участки своих молекул к жировой поверхности, в то время как участки этих молекул с меньшей гидрофобностью ориентированы в направлении воды.
Тем же путем воздействуют на соответствующие белковые слои и белки оболочек, обладающие слабой гидрофобностью, образуя градиент гидрофобности от поверхности жира к воде.
Градиент гидрофобности в такой оболочке делает ее идеальным местом для адсорбции молекул со всеми степенями гидрофобности. В частности, в структуре оболочки адсорбируются фосфолипиды и липолитические ферменты. Никакие реакции между ферментами и их субстратом не идут до тех пор, пока не будет нарушена структура оболочки, но как только это происходит, ферменты получают доступ к субстрату и начинают реагировать.
Примером таких реакций является липолитическое высвобождение жирных кислот, когда холодное молоко прокачивается неисправным насосом или после гомогенизации холодного сырого молока без последующей его незамедлительной пастеризации. Жирные кислоты и некоторые другие продукты этой ферментной реакции придают получаемому продукту прогорклый привкус.
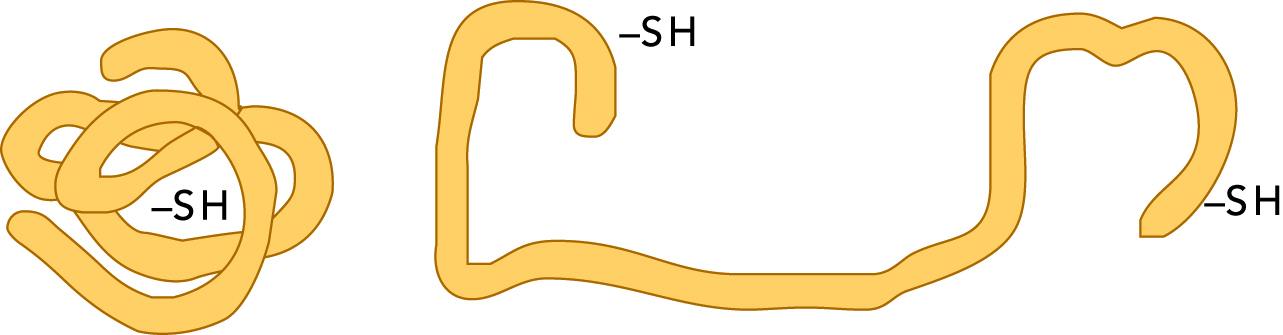
Денатурированные белки
До тех пор, пока белки находятся в окружающей среде при значениях температуры и рН, приемлемых для этих белков, они сохраняют свои биологические функции. Но при нагревании выше некоторого максимума их структура меняется. Говорят, что они денатурируются (см. рис. 2.36). То же самое происходит, когда белки обрабатываются кислотами или основаниями, подвергаются облучению или высокому давлению. В результате денатурации белки теряют свою природную растворимость.
При денатурации белков исчезает их биологическая активность. Ферменты, класс белков, выступающих катализаторами некоторых реакций, теряют эту способность во время денатурации. Причина этого состоит в том, что нарушаются определенные связи в их молекулах, вызывая изменение структуры белка. После слабого денатурирования белки могут иногда возвращаться в свое исходное состояние с восстановлением их прежних биологических функций.
Однако во многих случаях денатурация является необратимой. Например, белки сваренного яйца не могут быть восстановлены до сырого состояния.
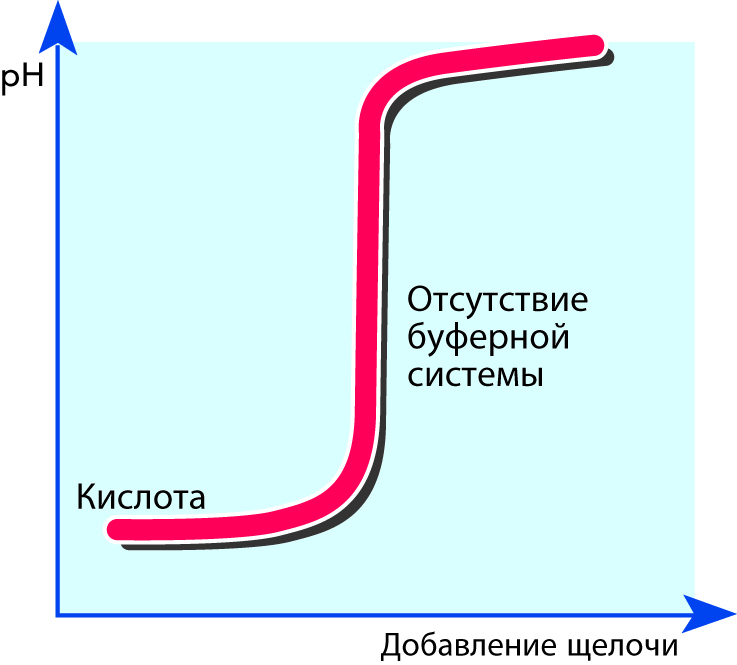
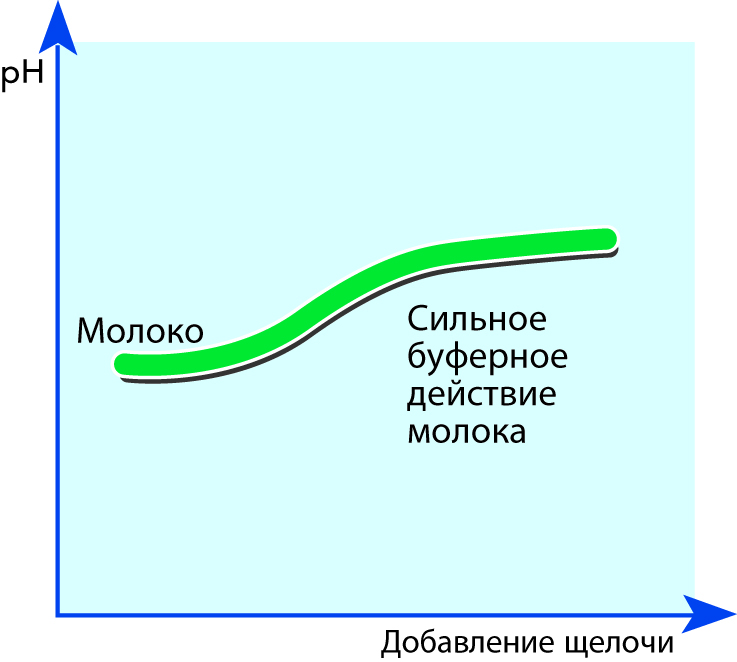
Молоко как буферный раствор
Молоко содержит огромное число веществ, которые могут действовать как слабые кислоты либо как слабые основания. Например, такие как молочная, лимонная и фосфорная кислоты и их соответствующие соли – лактаты, цитраты и фосфаты. В химии подобная система называется буферным раствором, потому что в некоторых пределах при добавлении кислот или оснований значение рН в ней остается постоянным. Это явление может быть объяснено специфическими свойствами белков.
При подкислении молока добавляется огромное количество ионов водорода (Н+). Почти все эти ионы связаны с аминогруппами в боковых цепях аминокислот с образованием ионов NH3+. При этом, однако, величина рН из-за очень незначительного повышения концентрации свободных ионов водорода почти не меняется.
При добавлении в молоко основания ионы водорода (Н+) выделяются из карбоксильных групп СООН боковых цепей с образованием групп COO-. В результате величина рН и в этом случае остается более или менее постоянной, см. рис. 2.38. Чем больше основания добавляется, тем большее число водородных ионов выделяется.
Другие компоненты молока также обладают этой способностью связывать или выделять ионы, и потому величина рН при добавлении кислот или оснований изменяется очень медленно.
Почти вся способность молока к буферизации является исчерпанной, если оно уже стало кислым из-за длительного хранения при повышенных температурах. В этом случае достаточно добавления лишь небольшого количества кислоты для изменения значения рН.
Ферменты присутствующие в молоке
Ферменты – это белки, способные инициировать химические реакции и влиять на ход и скорость этих реакций. Ферменты делают это, не изменяя своего количества. Поэтому иногда их называют биокатализаторами. Функционированиеферментовпроиллюстрировано на рис. 2.39.
Действие ферментов является избирательным; каждый тип ферментов катализирует только один определенный тип реакций. Двумя факторами, оказывающими сильное воздействие на ферментные реакции, являются температура и рН. Как правило, ферменты наиболее активны при оптимальной температуре в интервале 25–50 °С.
Их активность падает при ростетемпературы за пределы этого оптимума, полностью исчезая где-то в интервале 50–120 °С. При этих температурах ферменты практически полностью денатурируются (инактивируются). Температура инактивации у разных типов ферментов разная – явление, которое широко используют для определения степени пастеризации молока. У ферментов также есть оптимальный интервал значений рН: некоторые из них лучше всего функционируют в кислых растворах, а другие – в щелочных.
Ферменты, присутствующие в молоке, попадают в него или из коровьего вымени, или от бактерий. Первые из них являются естественными компонентами молока и называются первичными ферментами. Вторые, бактериальные ферменты, отличаются типом и численностью в соответствии с природой и величиной бактериальной популяции. Некоторые из ферментов молока используется для проверки его качества и контроля. В число наиболее важных ферментов входят пероксидаза, каталаза, фосфатаза и липаза.
Пероксидаза
Пероксидаза переносит кислород от пероксида водорода (H2O2) к другим легко окисляемым веществам. Этот фермент инактивируется в молоке нагреванием до 80 °С в течение нескольких секунд, этот факт может быть использован для установления наличия или отсутствия пероксидазы в молоке и, таким образом, для проверки того, была ли температура пастеризации молока выше 80 °С. Данный тест называют пробой Сторча (Storch) на пероксидазу.
Каталаза
Каталаза расщепляет пероксид водорода на воду и свободный кислород. Количественным определением кислорода, выделяемого этим ферментом, можно определить содержание каталазы в молоке и узнать, было ли получено это молоко от животного со здоровым выменем. Молоко животного с больным выменем содержит большое количество каталазы, в то время как в молоке из здорового вымени она присутствует в незначительном количестве. Однако существует большое количество бактерий, вырабатывающих данный фермент. Каталаза разрушается при нагреве до 75 °С в течение 60 секунд.
Фосфатаза
Фосфатаза обладает способностью расщеплять некоторые эфиры фосфорной кислоты на эту кислоту и соответствующий спирт. Присутствие фосфатазы в молоке может быть обнаружено добавлением эфира фосфорной кислоты и реагента, изменяющего окраску в результате взаимодействия с высвобождающимся спиртом. Изменение окраски свидетельствует отом, что молоко содержит фосфатазу.
Этот фермент разрушается при обычной пастеризации (температура 72 °С, выдержка 15–20 секунд), такимобразом, тест на фосфатазу может быть использован для определения, был ли реально соблюден температурный режим пастеризации. Этот стандартный тест, применяемый в молочном деле, называется тестом Шарера (Scharer) на фосфатазу.
Тест на фосфатазу предпочтительно проводить сразу же после термообработки. В противном случае молоко должно быть охлаждено ниже 5 °С и храниться при этой температуре до момента проведения анализа. Анализ должен быть проведен в тот же день, в противном случае может происходить процесс реактивации, то есть инактивированный фермент снова становится активным и дает положительный результат на тест. Этому, в частности, наиболее подвержены сливки.
Липаза
Липаза расщепляет жир на глицерин и свободные жирные кислот, см. рис. 2.40. Избыток свободных жирных кислот в молоке или молочных продуктах приводит к появлению прогорклого привкуса. Действие этого фермента, по-видимому, в большинстве случаев является очень слабым, хотя молоко от некоторых коров может обладать сильной липазной активностью. Считается, что количество липазы в молоке увеличивается к концу лактационного периода. Липаза в значительной степени инактивируется пастеризацией, но для ее полной инактивации требуются более высокие температурные режимы. Липазу выделяют многие микроорганизмы. Это может вызывать серьезные проблемы, так как этот фермент очень устойчив к нагреванию.
Лактоза в молоке
Лактоза является сахаром, присутствующим только в молоке, и принадлежит к группе химических соединений, называемых углеводами.
Углеводы являются наиболее важным источником энергии в нашей пище. Хлеб и картофель, например, богаты углеводами и являются источниками питательных веществ. Углеводы распадаются на соединения, обладающие высокой энергетической ценностью, способные участвовать во всех биохимических реакциях, обеспечивая их необходимой энергией. Углеводы также служат материалом для синтеза некоторых важных химических соединений в организме. Они присутствуют в мышцах в виде мышечного гликогена и в печени – в качестве гликогена печени.
Гликоген является примером углевода с очень большой молекулярной массой. Другими примерами подобных углеводов являются крахмал и целлюлоза. Подобные сложные углеводы называются полисахаридами и имеют гигантские молекулы, составленные из большого числа молекул глюкозы. В гликогене и крахмале молекулы часто разветвлены, в то время как в целлюлозе они существуют в виде прямых и длинных цепей.
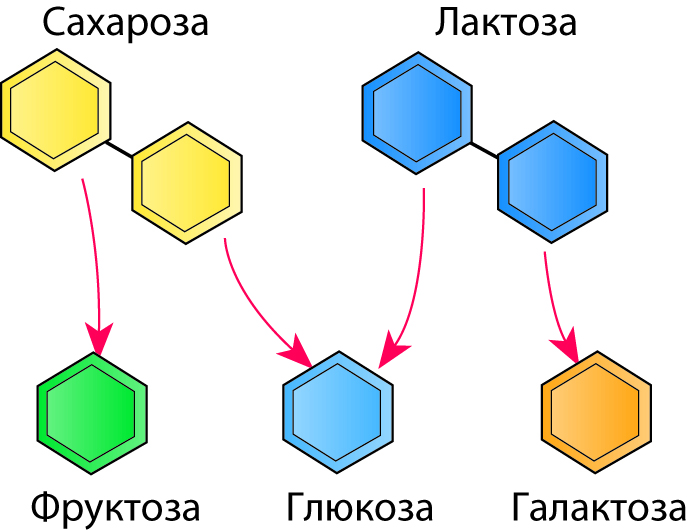
Рис. 2.41 показывает некоторые дисахариды, то есть углеводы, состоящие из двух типов молекул сахаров. Молекулы сахарозы (обычный тростниковый или свекловичный сахар) состоят из двух простых сахаров (моносахаридов) – фруктозы и глюкозы. Лактоза (молочный сахар) является дисахаридом, молекула которого содержит моносахариды – глюкозу и галактозу.
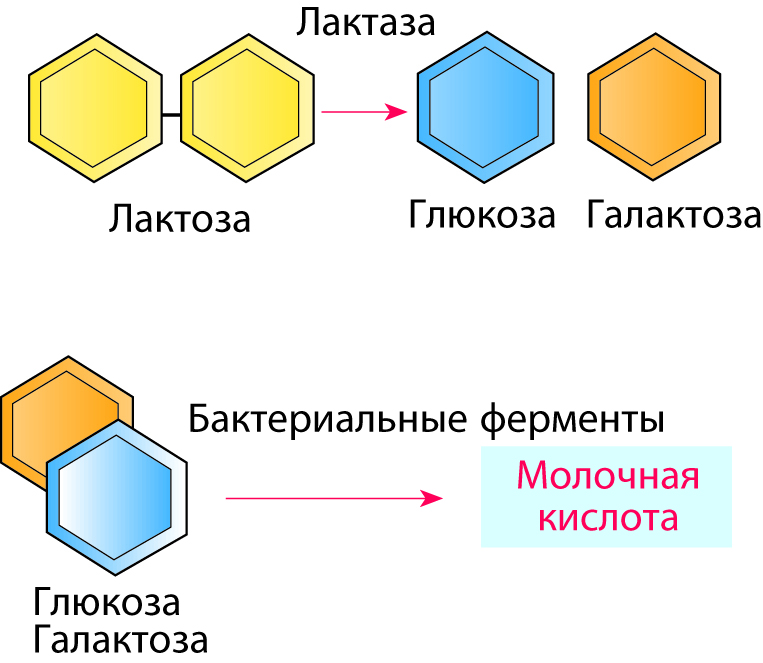
Таблица 2.3 показывает, что содержание лактозы в молоке составляет от 3,6 до 5,5 %. Рис. 2.42 иллюстрирует, что происходит, когда лактоза распадается под действием молочнокислых бактерий. Лактоза попадает в бактериальную клетку, где подвергается воздействию ферментов, расщепляющих ее на глюкозу и галактозу. В свою очередь глюкоза и галактоза под воздействием других ферментов, вырабатываемых молочнокислыми бактериями, путем сложных промежуточных реакций в основном превращаются в молочную кислоту. Ферменты, участвующие в этих реакциях, действуют в определенном порядке. Именно это происходит, когда прокисает молоко: лактоза сбраживается до образования молочной кислоты. Другие микроорганизмы выделяют в молоке иные продукты распада.
При нагревании и выдерживании молока при высокой температуре оно приобретает коричневатый оттенок и привкус карамели. Этот процесс называется карамелизацией и является следствием химической реакции между лактозой и белками, называемой реакцией Майяра (Maillard).
Реакции Майара запускаются термической обработкой и продолжаются во время хранения продукта. Кинетика данной реакции напрямую зависит от таких факторов, как тепловая нагрузка и температура хранения.
Лактоза является водорастворимой и присутствует в виде молекулярного раствора в молоке. При сыроварении основная часть лактозы остается растворенной в сыворотке. Выпаривание сыворотки при приготовлении сывороточных сыров дополнительно повышает концентрацию лактозы. Лактоза не такая сладкая, как другие сахара; например, она примерно в 7 раз менее сладкая, чем тростниковый сахар.
Витамины в молоке
Витамины являются органическими веществами, присутствующими в растениях и в организмах животных в очень низких концентрациях. Они совершенно необходимы для нормальной жизнедеятельности, однако их синтез в организме невозможен. Химический состав витаминов обычно очень сложен, но известен в настоящее время для большинства из них. Витамины обозначаются заглавными буквами, иногда сдополнительными численными подстрочными обозначениями, например А, B1 и B2.
Молоко является хорошим источником витаминов, которые присутствуют в нем в различных количествах. В число наиболее известных входят: витаминА, витаминыгруппыВ, витамины С и D. Витамины А и D растворимы в жирах и жирных растворителях, в то время как другие витамины растворимы в воде. Из жирорастворимых витаминов наиболее важными являются A и D. Они влияют на зрение и кожу. В силу естественных причин обезжиренные молочные продукты содержат меньше этих витаминов. Во многих странах их недостаток в обезжиренном молоке компенсируется добавками витаминов А и D, чтобы уровень содержания витаминов был как в цельном молоке.
В таблице 2.6 приведено количество различных витаминов в 1 литре питьевого молока и ежедневная потребность в них у взрослого человека. Таблица демонстрирует, что молоко является хорошим источником витаминов. Недостаток витаминов может привести к заболеваниям, см. таблицу 2.7.
Минералы и соли в молоке
Молоко содержит ряд минеральных веществ. Их общая концентрация менее 1 %. Минеральные соли присутствуют в растворенном виде в молочной сыворотке или в соединениях казеина. Наиболее важными солями являются соли кальция, натрия, калия и магния. Они присутствуют в виде фосфатов, хлоридов, цитратов и казеинатов. В обычном молоке больше всего солей калия и кальция. Количество солей в молоке непостоянно. К концу лактации и особенно при заболевании вымени содержание хлористого натрия в молоке повышается, придавая молоку соленый привкус, в то время как количество других солей соответственно понижается.
Другие компоненты молока
Молоко всегда содержит соматические клетки (белые кровяные клетки или лейкоциты). Их содержание в молоке, полученном из здорового вымени, незначительно, но повышается при его заболевании (обычно пропорционально тяжести заболевания). Содержание соматических клеток в молоке здоровых животных, как правило, не превышает 200 000 в 1 мл, хотя допустимо содержание до 400 000 клеток в 1 мл.
Молоко также содержит газы, порядка 5–6 % от объема свежего молока, но по прибытии молока на молочное предприятие это содержание может повыситься до 10 % в объеме. Газы состоят в основном из диоксида углерода, азота и кислорода.
Они находятся в молоке в трех состояниях:
1 растворенные в молоке;
2 связанные и невыделяемые из молока;
3 диспергированные в молоке.
Диспергированные и растворенные газы представляют серьезную проблему при обработке молока, которое при наличии излишков газов может пригорать на нагревательных поверхностях.
Изменения в молоке и его компонентах
Изменения при хранении
Жир и белок, содержащиеся в молоке, при хранении могут подвергаться химическим изменениям. Данные изменения обычно бывают двух видов – окисление или полиз. Продукты, получаемые в результате этих изменений, могут ухудшать вкус (в основном у молока и масла).
Окисление жира
Окисление жира приводит к появлению у него металлического привкуса, а у масла – привкуса сала или растительного масла. Окисление идет по двойным связям ненасыщенных жирных кислот, среди которых лецитин наиболее подвержен этому процессу. Присутствие солей железа и меди, так же как наличие растворенного кислорода и облучение светом, особенно прямым солнечным светом или светом от люминесцентных ламп, ускоряет начало самоокисления и появление металлического привкуса.
Окисление жира частично может быть компенсировано микроорганизмами молока, пастеризацией при температуре выше 80 °С или антиоксидантными добавками (восстановителями). Микроорганизмы, например молочнокислые бактерии, потребляют кислород и обладают восстанавливающей способностью. Ухудшение вкуса, вызванное окислением, чаще возникает при низких температурах, когда эти бактерии менее активны. Также при низких температурах растет растворимость кислорода в молоке. Помогает высокотемпературнаяпастеризация, таккакпринагреваниимолокаобразуютсясоединения- восстановители (-SH-группы).
Появление металлического привкуса в результате окисления более характерно для зимы, чем для лета. Это связано как с понижением внешней температуры, так и с изменениями в рационе коров. Летом корма богаче витаминами А и С, повышающими содержание соединений-восстановителей в молоке.
Под действием света и/или в присутствии ионов тяжелых металлов процесс распада жирных кислот идет дальше – сначала на альдегиды потом на кетоны, что ведет к ухудшению вкуса у жирных молочных продуктов, например к появлению прогорклого привкуса.
Окисление белков
Под действием света аминокислота метионин при сложном совместном воздействии рибофлавина (витамин В2) и аскорбиновой кислоты (витамин С) распадается до метионаля. Метиональ, или 3-меркаптометилпропионовый альдегид, является основным фактором появления «солнечного привкуса», как называют этот специфический привкус.
Так как метионин как таковой не присутствует в молоке, а является лишь одним из компонентов белков молока, то для появления этого привкуса должна произойти фрагментация белков.
Факторами, связанными с появлением солнечного привкуса, являются:
- интенсивность освещения (солнечного и/или искусственного света, особенно от люминесцентных ламп);
- продолжительность воздействия света;
- некоторые свойства молока (гомогенизированное молоко оказалось более чувствительным в этом отношении, чем негомогенизированное);
- материал упаковки – непрозрачная упаковка из полимеров и бумаги при обычных условиях является хорошей защитой.
См. также главу 8, посвященную сохранению качества пастеризованного молока.
Липолиз
Липолизом называют расщепление жиров на глицерин и свободные жирные кислоты. Расщепленный жир имеет прогорклый привкус и запах в результате присутствия низкомолекулярных жирных кислот (масляной и капроновой).
Липолиз вызывается действием липаз, и ему благоприятствуют высокие температуры хранения. Однако липаза не может воздействовать на жир, пока его шарики не будут повреждены, и он не выйдет наружу, см. рис. 2.43. Только после этого липаза получает возможность воздействовать на молекулы жира и гидролизовать их. При обычной обработке молока имеется множество возможностей для повреждения шариков жира, например при перекачивании, перемешивании и разбрызгивании молока. Поэтому необходимо избегать ненужного взбалтывания непастеризованного молока, так как это связано с риском масштабного воздействия липазы и появления жирных кислот, из-за которых молоко будет горчить. Для предотвращения распада жира под действием липазы она должна быть инактивирована высокотемпературной пастеризацией. Пастеризация полностью разрушает исходные ферменты молока. Бактериальные ферменты более устойчивы. Даже UHT- обработка не разрушает их полностью (UHT = ультравысокая температура, то есть нагрев до 135–150 °C и выше на несколько секунд).
Влияние тепловой обработки
На молочных предприятиях молоко подвергают тепловой обработке для уничтожения любых патогенных микроорганизмов, которые могут в нем присутствовать. Тепловая обработка также вызывает изменения в компонентах молока. Эти изменения тем глубже, чем выше температура и длительнее термообработка. В определенных пределах температура и время могут компенсировать недостаточность другого параметра. Кратковременное нагревание до высоких температур может быть также эффективно, как и продолжительное воздействие менее высоких температур. Следовательно, при тепловой обработке необходимо всегда учитывать и время, и продолжительность нагревания.
Жир
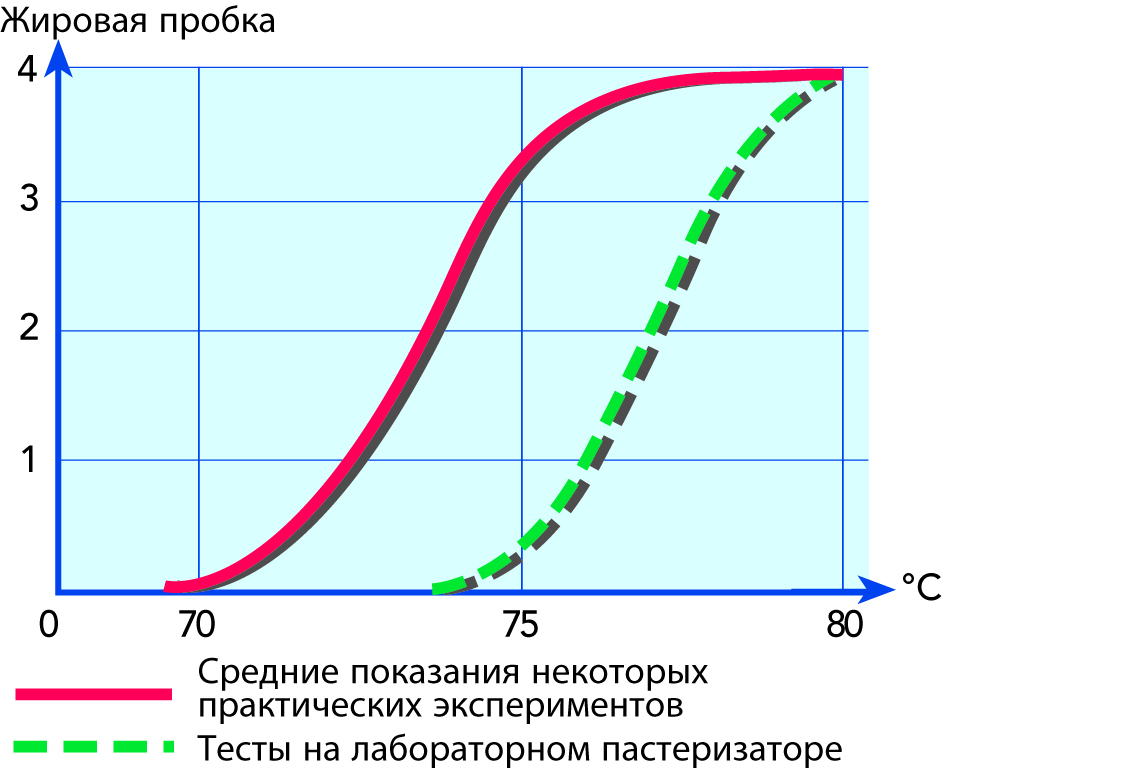
Из всех основных компонентов тепловая обработка, вероятно, оказывает наименьшее воздействие на жир. Однако под воздействием термообработки в молочном жире происходят изменения, и в первую очередь это касается физических свойств. Основным влиянием термообработки на молочный жир является образование сливок из жировых шариков. Было показано, что формирование отстойной жировой пробки происходит, когда молоко пастеризуют при 70–80 °C в течение 15 секунд (Thomé et al, «Наука о молоке», 13, 115, 1958 г.), см. рис. 2.44. Выдвигались различные теории, но, скорее всего, выделяемый свободный жир склеивает шарики жира при их столкновении. Для предотвращения образования отстойной жировой пробки рекомендуется гомогенизировать молоко.
А. Финк и Х. Г. Кесслер («Наука о молоке», 40, 6–7, 1985 г.) подтвердили появление свободного жира в гомогенизированных и негомогенизированных сливках с м. д. ж. 30 %, подвергнутых тепловой обработке при температуре 105–135 °С. Считается, что это объясняется дестабилизацией мембран шариков, приводящей к повышению их проницаемости, в результате чего экстрагируемый свободный жир выступает в качестве связующего между сталкивающимися жировыми шариками, что ведет к образованию стабильных скоплений.
При температуре выше 135 °С белки, отложившиеся на оболочке шариков жира, образуют своего рода сетку, делающую оболочку более плотной и менее проницаемой. Поэтому при UHT-обработке продуктов с высоким содержанием жира поток из стерилизатора рекомендуется гомогенизировать.
Образования отстойной жировой пробки на молоке как функция температуры пастеризации. Масштаб от 0 (без воздействия) до 4 (плотная жировая пробка). Вся пастеризация была кратковременной (примерно 15 сек). Источник: Thomé et al.
Белок
Считается, что основной белок молока, казеин, не подвергается денатурации в результате тепловой обработки при обычных значениях рН, концентрации соли и содержания белка.
С другой стороны, сывороточные белки, особенно b-лактоглобулин, составляющий до 50 % этих белков, являются термочувствительными. Денатурация начинается при 65 °С и почти завершается при нагревании сывороточных протеинов в течение 5 минут при 90 °С.
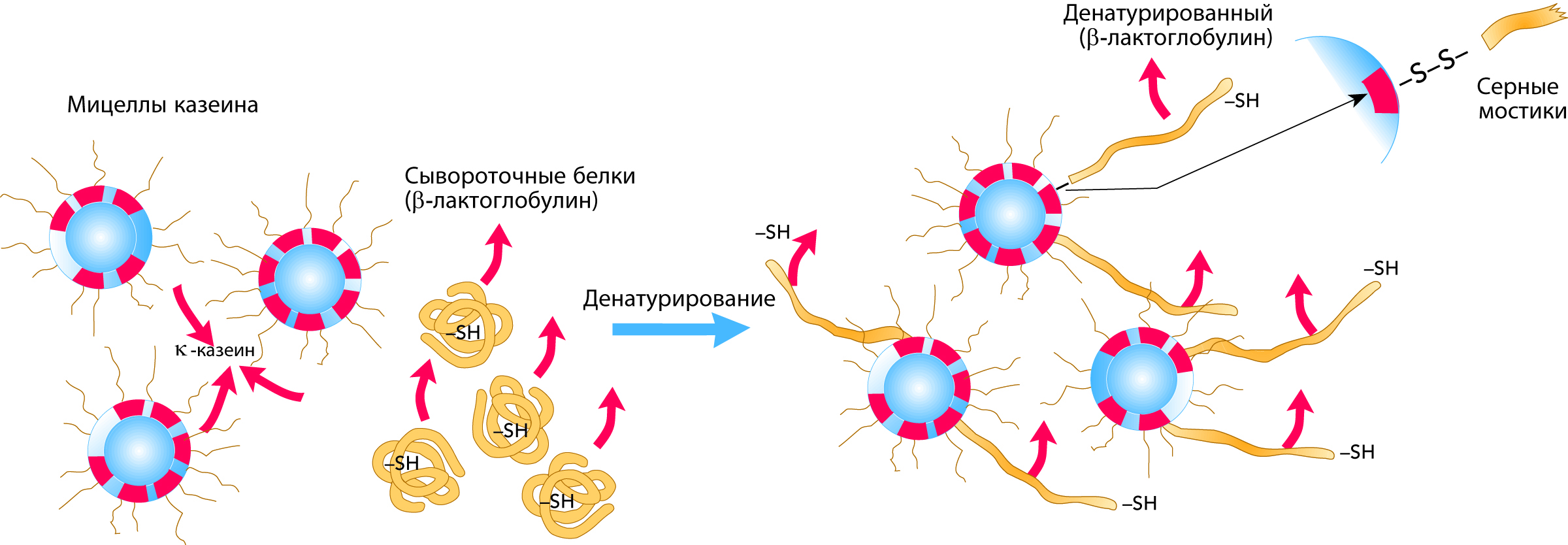
Тепловая денатурация сывороточных протеинов является необратимой реакцией. Произвольно скрученные белки «раскрываются», а b-лактоглобулин, в частности, присоединяется к выступающей k-казеиновой цепочке при помощи серных мостиков. Данная тансформация в упрощенной форме показана на рис. 2.45.
Блокировка большей части k-казеина ухудшает сычужную свертываемость молока, так как она отрицательно влияет на способность сычужного фермента, используемого в сыроварении, отделять k-казеин от мицелл казеина. Чем выше температура пастеризации при постоянном времени выдержки, тем мягче образующийся сгусток. Это нежелательное явление при производстве полутвердых и твердых сыров. Однако с учетом возможности выживания и последующего размножения в сыре, приготовленном из сырого молока, патогенных бактерий (в частности, Listeria monocytogenes), рекомендуется пастеризовать молоко, предназначенное для производства сыров, в течение 15–20 секунд и при температуре не выше 72 °С. Возможно приготовление сыра из сырого молока, но только в строгом соответствии с национальным законодательством.
В молоке, предназначенном для приготовления кисломолочных продуктов (йогурта и т. д.), денатурация сывороточных белков и соединение с казеином, происходящее притемпературе 90–95 °С при выдержке в течение 3–5 минут, будет способствовать повышению качества благодаря уменьшению синерезиса и повышению вязкости.
Молоко, нагретое при 75 °С в течение 20–60 секунд, приобретает привкус и запах «кипяченого». Это обусловлено выделением соединений серы из b-лактоглобулина и других серосодержащих белков.
При температуре выше 100°Cпроисходит реакция между лактозой и белком, ведущая к появлению коричневатой окраски.
Ферменты
Ферменты могут быть инактивированы нагреванием. Температура инактивации зависит от типа фермента.
Существуют некоторые микроорганизмы (например, Pseudomonas spp.), часто упоминаемые в числе флоры, способной вызывать как порчу сырого молока, хранимого при низких температурах, так и молочных продуктов, подвергнутых тепловой обработке; у них имеются исключительно термостойкие протеолитические и липолитические ферменты. Пастеризация или UHT-обработка молока вызывают только частичное подавление их активности.
Лактоза
Лактоза легче поддается изменениям в молоке, чем в сухом состоянии. При температуре выше 100 °C происходит реакция между лактозой и белком, ведущая к появлению коричневатой окраски. Ряд реакций, происходящих между аминогруппами аминокислотных остатков и альдегидными группами углеводов молока, называется реакцией Майяра, или реакцией побурения. Она ведет к появлению коричневого оттенка у продукта, к изменению вкуса и к потере питательной ценности, в частности к потере лизина – одной из незаменимых аминокислот.
Лактулоза является эпимером лактозы, образующимся в нагретом молоке (Adachi, 1958 г.). Содержание лактулозы повышается с возрастанием интенсивности тепловой обработки, что может быть использовано для дифференциации между пастеризованным, стерилизованным и молоком после UHT-обработки (Мартинез Кастро & Олано, 1982 г., и Гэйер & Клостермайер, 1983 г.).
Витамины
Молоко является важным источником витаминов A, D и группы B. Жирорастворимые витамины оченьтермостойки, и их уровень не снижается после теплообработки. Однако если молоко обогащено витамином А, создается впечатление, что относительные потери растут. Потери витаминов в основном затрагивают витамин С и некоторые витамины группы В. Потеря витамина С как таковая обычно не столь важна, так как молоко не является важным источником этого витамина, но в любом случае питательные свойства продукта могут пострадать. Разрушение витамина С связано с разрушением витамина B12 и служит защитой фолиевой кислоты от окисления.
Разрушение витаминов связано не только с термообработкой, но также с хранением конечного продукта. Потерю витаминов при хранении в значительной степени можно избежать, если исключить проникновение кислорода и света. Витамины C и B9 могут совсем исчезнуть за несколько дней при хранении в атмосфере, богатой кислородом. Катализатором этой реакции служит рибофлавин (витамин B2), и ее ускоряет сильный свет. Основная часть рибофлавина исчезает после длительного пребывания на свету.
Потери некоторых витаминов в результате различных типов обработки представлены в Таблице 2.8.
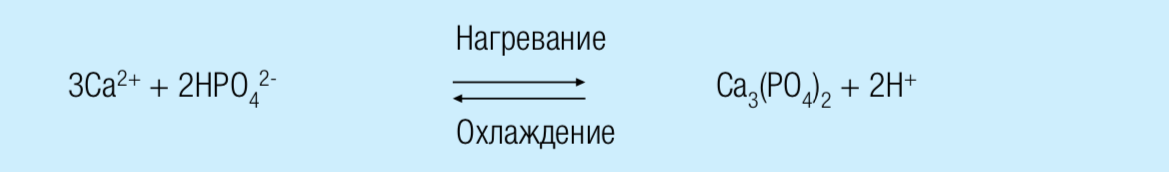
Минералы
Растворимость гидрофосфата кальция в значительной степени зависит от температуры. В отличие от остальных компонентов растворимость гидрофосфата кальция понижается с повышением температуры. Это означает, что нагревание вызывает осаждение фосфата кальция в мицелле в виде КФК, в то время как охлаждение повышает концентрацию растворимого гидрофосфата кальция. После охлаждения реакция может быть обращена, но после нагревания до высокихтемператур обратимость становится менее быстрой и полной.
Изменения при высокой температуре означают, что молоко становится более кислым, рН падает, как указано в таблице 2.9 ниже.
Изменения значения рН могут быть объяснены следующим образом:
Изменения в рН увеличиваются, если молоко концентрированное.
Физические свойства молока
Внешний вид
Мутность молока обусловлена наличием в нем взвешенных частиц жира, белков и некоторых минералов. Цвет молока меняется от белого до желтого в соответствии с окраской жира (в зависимости от содержания каротина). Обезжиренное молоко более прозрачно и имеет слабый голубоватый оттенок.
Плотность
Плотность коровьего молока меняется в пределах 1,028–1,038 г/см3 в зависимости от состава. Плотность (d) молока при 15,5 °С может быть рассчитана по нижеприведенной формуле, в которой:
Ниже приведен пример.
Осмотическое давление
Осмотическое давление определяется числом молекул или частиц, а не массой растворенного вещества; так, 100 молекул с массой в 10 условных единиц будут иметь в 10 раз большее осмотическое давление, чем 10 молекул с массой в 100 единиц.
Следовательно, для данной массы, чем меньше молекулярная масса, тем выше осмотическое давление.
Молоко синтезируется из крови и отделяется от нее проницаемой мембраной, и, таким образом, имеет с кровью одинаковое осмотическое давление, иными словами, является изотоническим раствором относительно крови. Осмотическое давление крови обладает превосходным постоянством, несмотря нато что ее состав (содержание таких компонентов, как пигменты, белки и т. п.) может меняться. Это же относится и к молоку, общее осмотическое давление которого представлено в таблице 2.10.
Температура замерзания
Температура замерзания молока является единственным надежным параметром для проверки, разбавлено оно водой или нет. Температура замерзания для коровьего молока лежит в пределах от -0,51 °С до -0,56 °С.
Следует также упомянуть, что при высокотемпературной обработке молока (например, при UHT-обработке или стерилизации) осаждение части фосфатов может вызвать повышение его температуры замерзания.
Внутреннее, или осмотическое, давление также определяет разность между температурами замерзания у раствора и растворителя (воды), так что понижение температуры замерзания (D в таблице 2.10) служит мерой осмотического давления. В случае получения анормального молока при изменении состава молока по физиологическим или патологическим причинам (например, из-за поздней лактации или мастита соответственно) осмотическое давление и, следовательно, температура замерзания остаются неизменными. Наиболее важным изменением при этом будет падение содержания лактозы и повышение содержания хлорида.
Кислотность
Кислотность раствора зависит от концентрации в нем ионов водорода [Н+]. Если концентрации ионов [H+] и [OH-] (гидроксильные) равны, раствор называют нейтральным. В нейтральном растворе число [H+] на литр такого раствора равно 1:10 000 000 моль/л, или 10-7 моль/л.
Величина рН характеризует концентрацию ионов водорода в растворе и математически может быть определена как отрицательный логарифм концентрации этих ионов [Н+].
Применительно к вышеприведенному примеру pH = -log 10-7 = 7 , что является типичным значением рН для нейтрального раствора. В случае если [H+] равна 1:1 000 000 моль/л, или 10–6 моль/л, рН будет равен 6 и раствор будет кислотным. Чем ниже значение рН, тем выше кислотность.
Величина рН раствора или продукта представляет собой фактическую (действительную) кислотность. Нормальное молоко является слабокислым раствором с рН в диапазоне 6,65–6,85, при этом наиболее типичное значение составляет рН 6,70 при температуре измерения 25 °C. Показатель рН измеряют рН-метром.
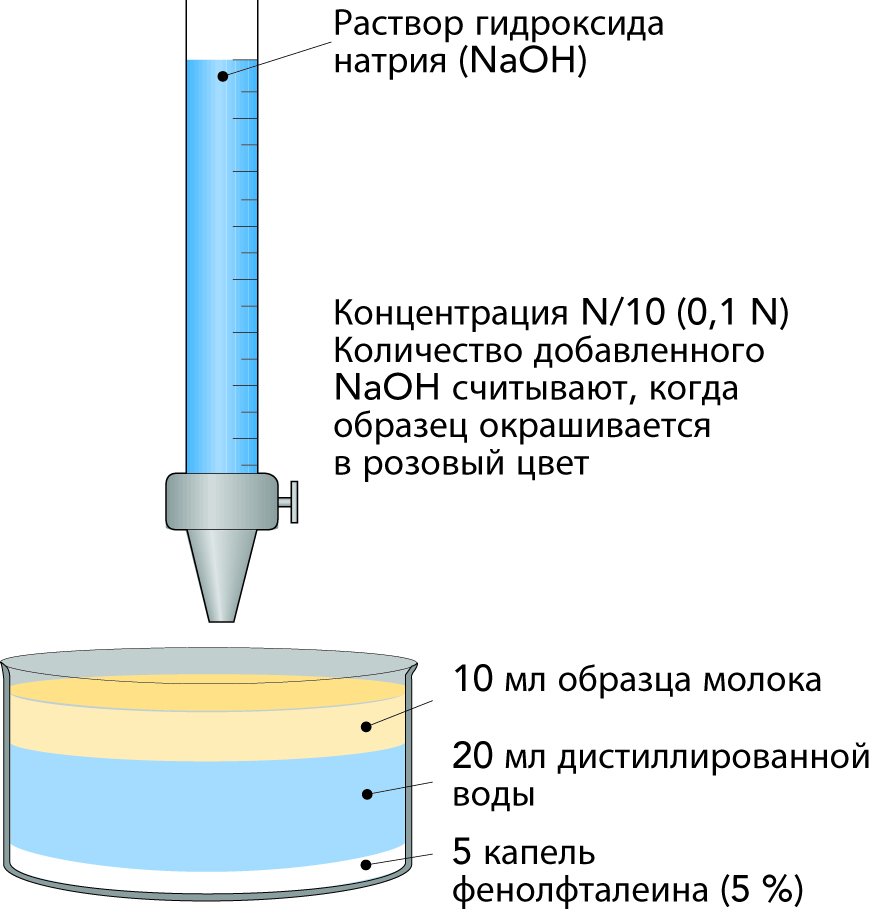
Титруемая кислотность
Кислотность также может быть выражена в виде титруемой кислотности. Титруемая кислотность молока представляет собой количество раствора щелочи (гидроксид ионов OH-) заданной концентрации, необходимое для повышения рН определенного количества молока примерно до 8,4, при котором обычно применяемый индикатор фенолфталеин изменяет окраску с бесцветной на розовую. Фактически этот тест определяет количество щелочи, необходимое для изменения рН с 6,7 на 8,4.
Если молоко скисло в результате деятельности микроорганизмов, потребуется большее количества щелочи, и кислотность или показатель титруемой кислотности молока увеличится. В зависимости от концентрации используемого для титрования раствора гидроксида натрия (NaOH) титруемая кислотность может быть выражена в разных единицах.
- °SH = градусы Сокслета-Хенкеля, получаемые титрованием 100 мл молока раствором N/4 NaOH в присутствии индикатора фенолфталеина. Обычное молоко имеет показатель, равный примерно 7. Этот метод получил широкое распространение в Центральной Европе.
- °Th = градусы Тернера, получаемые титрованием 100 мл молока, разбавленного 2 частямидистиллированнойводы, N/10 раствором NaOH с использованием фенолфталеина в качестве индикатора. Обычное молоко имеет показатель, равный примерно 17. Применяют главным образом в Швеции.
- °D = градусы Дорника, получаемые титрованием 100 мл молока раствором N/9 NaOH с использованием фенолфталеина в качестве индикатора. Обычное молоко имеет показатель равный примерно 15. Применяют в основном в Нидерландах и во Франции.
- % l. a. = проценты молочной кислоты, получаемые как градусы Дорника (°D) с делением результата на 100. Часто применяются в Великобритании, США, Канаде, Австралии и Новой Зеландии.
Втаблице 2.11 приведены различные выражения длятитруемой кислотности. Определение кислотности в градусах Тернера изображено на рисунке 2.46.
Пример:
для титрирования 10 мл молока необходимо 1,7 мл N/10 NaOH.
Таким образом, для 100 мл молока понадобится 10 x 1,7 = 17 мл, при этом кислотность молока составляет 17 °T.
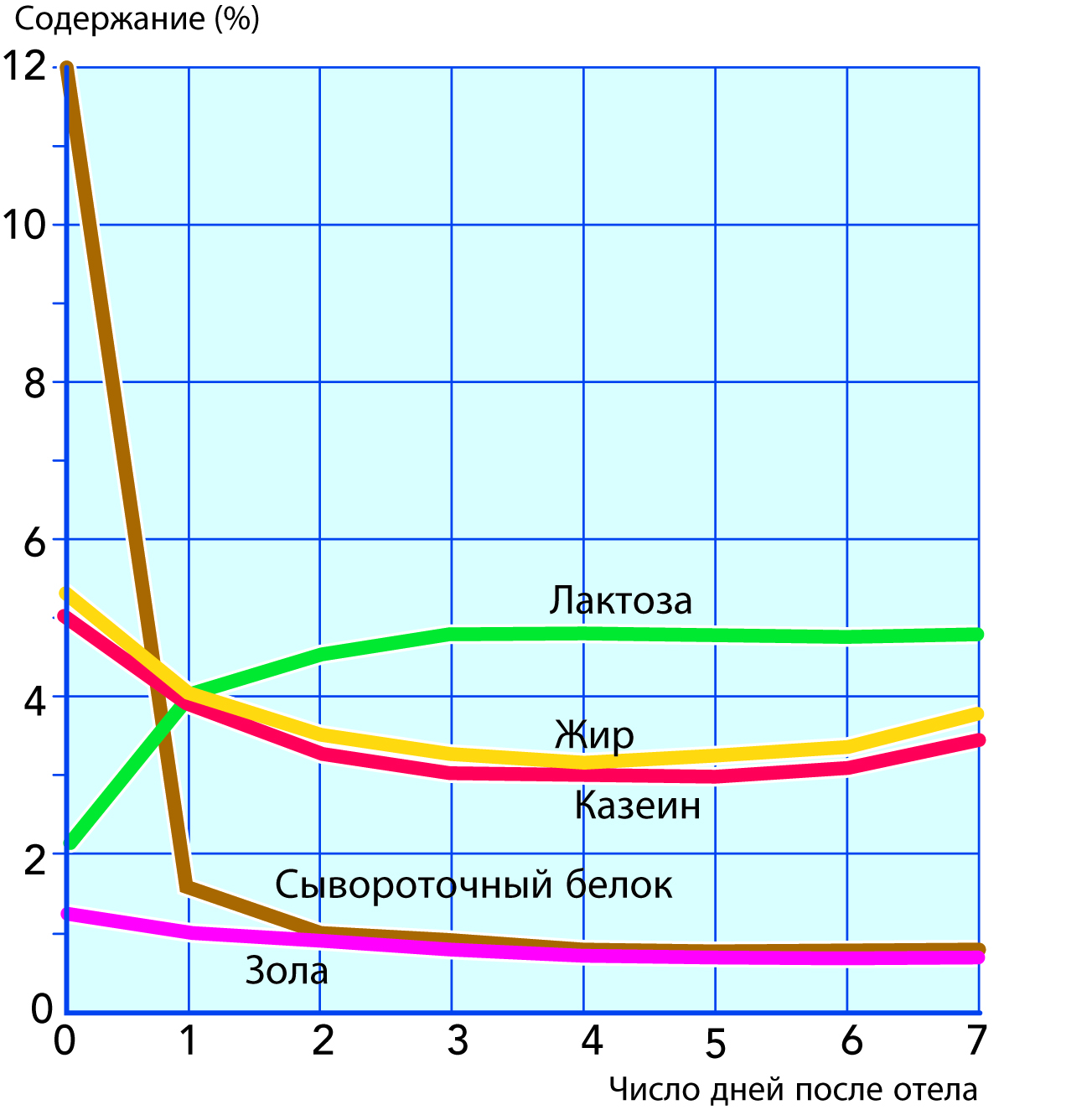
Молозиво
Первое молоко, которое дает корова после отела, называют молозивом. Оно в значительной степени отличается от нормального молока по составу и свойствам. Самым значительным отличием молозива является высокое содержание сывороточных белков – около 11 % по сравнению с примерно 0,65 % в обычном молоке, как это показано на рис. 2.47. Это приводит к свертыванию молозива при нагревании. Доминирующую часть его сывороточных белков составляют иммуноглобулины (в основном класса G), которые защищают теленка от инфекций до образования его собственной иммунной системы. Молозиво имеет желтовато-коричневатый цвет, специфический запах и довольно солоноватый привкус. Содержание каталазы и пероксидазы является высоким. Через 4–5 дней после отела корова начинает выделять молоко обычного состава, которое может быть смешано с другим молоком.